-
根据以下事实得出的判断一定正确的是( )
A.HA的酸性比HB的强,则HA溶液的pH比HB溶液的小
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关.下列有关说法中,错误的是( )
A.利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性难度: 中等查看答案及解析
-
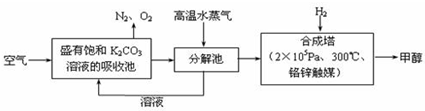
为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
选项 被提纯的物质(杂质) 除杂试剂 分离方法 A NH3(H2O) 浓硫酸 洗气 B H2O(Br2) CCl4 分液 C KCl固体(I2) KOH溶液 加热 D 苯(苯酚) 浓溴水 过滤
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
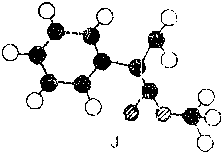
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
A.迷迭香酸属于芳香烃
B.迷迭香酸可以发生水解、消去、取代和酯化反应
C.1mol迷失香酸最多能和含6mol NaOH的水溶液完全反应
D.1mol迷迭香酸最多能和9mol氢气发生加成,和6mol溴发生取代反应难度: 中等查看答案及解析
-
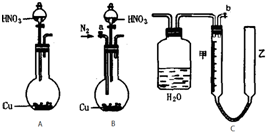
某课外实验小组设计的下列实验合理的是( )
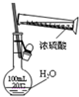
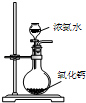

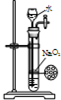
A.配制一定浓度硫酸溶液 B.制备少量氨气 C.制备并收集少量NO2气体 D.制备少量氧气
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓
B.漂白粉溶液露置在空气中会失效:ClO-+CO2+H2O═HClO+HCO3-
C.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O
D.CH3COOH是弱电解质:CH3COO-+H2O⇌CH3COOH+OH-难度: 中等查看答案及解析
-
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
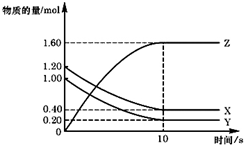
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积扩大为4 L,平衡向逆反应方向移动
C.T℃时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率为60%
D.T℃时,该反应的化学方程式为:X(g)+Y(g)⇌2Z(g),平衡常数K=40难度: 中等查看答案及解析