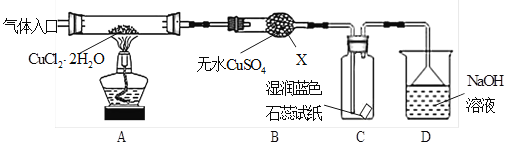
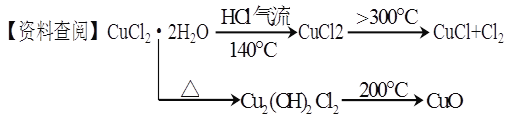-
银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是
A. 硫的还原性
B. 硫的漂白性
C. 二氧化硫的还原性
D. 二氧化硫的漂白性
难度: 中等查看答案及解析
-
下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在棕色玻璃试剂瓶中,且要用橡胶塞密封好。
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C. 点燃的镁条不能在二氧化碳气体中继续燃烧
D. 含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
难度: 中等查看答案及解析
-
某无色酸性溶液中,则该溶液中一定能够大量共存的离子组是 ( )
A.Fe2+、Ba2+、NO3-、Cl- B.Na+、NH4+、SO42-、Cl-
C.Na+、K+、SO32-、NO3- D.Na+、K+、MnO4-、Br-
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B. 氯气跟水反应:Cl2+ H2O= H++ Cl-+ HClO
C. 钠与水的反应:Na+H2O=Na++OH-+H2↑
D. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
难度: 简单查看答案及解析
-
从海水(含氯化镁)中提取镁,可按如下步骤进行:①把贝壳制成石灰乳[Ca(OH)2]; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中提取MgCl2
C. 以上提取镁的过程中涉及分解、化合和复分解反应
D. 第④步电解不是氧化还原反应
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 3mol NO2与足量H2O反应,转移的电子数为NA
B. 14 gN2和CO混合气体中的原子总数为NA
C. 标准状态下,22.4L氦气含有2NA个氦原子
D. 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 硅胶可作袋装食品的干燥剂
B. 燃料不完全燃烧排放的CO是大气污染物之一
C. Ba2+浓度较高时危害健康,但BaSO4可服人体内,作为造影剂用于X-射线检查肠胃道疾病
D. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
难度: 中等查看答案及解析
-
利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是( )
A. 可生成H2的质量为0.02g
B. 可生成氢的原子数为2.408×1023个
C. 可生成H2的体积为0.224L(标准状况)
D. 生成H2的量理论上等于0.04mol Na与水反应产生H2的量
难度: 中等查看答案及解析
-
(2016·北京卷) 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
难度: 困难查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则消耗的H2S为0.1mol
D. 还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( )
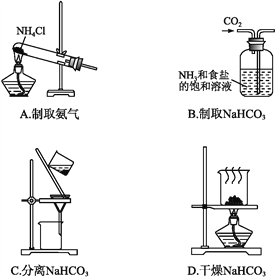
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是
A. 过量的铜与浓HNO3 B. 过量的浓盐酸与二氧化锰
C. 过量的铜与浓硫酸 D. 过量的锌与18 mol/L硫酸
难度: 中等查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
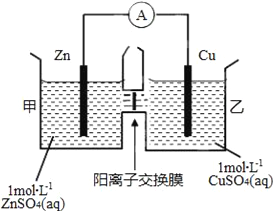
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42﹣)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
实验室提纯含少量氯化钠杂质的硝酸钾的过程如下图所示。下列分析正确的是
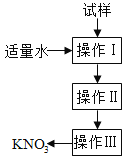
A. 操作Ⅰ是过滤,将固体分离除去
B. 操作Ⅱ是加热浓缩。趁热过滤,除去杂质氯化钠
C. 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D. 操作Ⅰ~Ⅲ总共需两次过滤
难度: 中等查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH=1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B. 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C. 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D. 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 困难查看答案及解析