-
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜器出现铜绿 B.过氧化钠作供氧剂
C.大理石雕像被酸雨腐蚀毁坏 D.铝锅表面生成致密的薄膜
难度: 中等查看答案及解析
-
用NA表示阿伏加德岁常数的值下列说法正确的是( )
A.标准状况下,22.4L H2O中含有的分子数为NA
B.含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05 NA
C.7.lgCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2 NA
D.1L lmol/L CaCl2溶液中含有的氯离子数为NA
难度: 中等查看答案及解析
-
分类法是重要的科学研究方法,下列物质归类正确的是( )
A.碱:苛性钠、纯碱、熟石灰
B.碱性氧化物:氧化铜、七氧化二锰、氧化铝
C.盐:胆矾、小苏打、铜绿
D.无丁达尔现象的分散系:碘的四氧化碳溶液、淀粉溶液、氯化铁溶液
难度: 中等查看答案及解析
-
有关钠的化合物的说法正确的是( )
A.Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物
B.向饱和NaCO3溶液中通入足量CO2,反应的离子方程式为CO2+H2O+CO32—=2HCO3—
C.固体NaOH的潮解和Na2CO3·10H2O的风化均为物理变化
D.NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行
难度: 中等查看答案及解析
-
配制250mL 0.1mol/L的盐酸溶液时,下列实验操作使配制溶液的浓度偏小的是( )
A.用量筒量取所需浓盐酸时俯视刻度线
B.定容时,俯视刻度线
C.用量筒量取浓盐酸倒入烧杯后,用水洗涤量筒2~3次,洗涤液倒入烧杯中
D.定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,可以不管它
难度: 中等查看答案及解析
-
下列污染现象主要与NO2有关的是( )
A.臭氧空洞 B.水体富营养化 C.光化学烟雾 D.温室效应
难度: 简单查看答案及解析
-
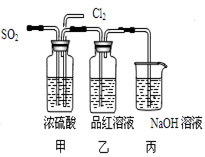
下列实验能证明一定有SO2存在的是( )
①能使澄清石灰水变浑浊
②能使湿润的蓝色石蕊试纸变红
③能使品红溶液褪色
④通入足量的NaOH溶液,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸
⑤通入溴水能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成
A.都能证明 B.都不能证明 C.③④⑤能证明 D.只有⑤能证明
难度: 中等查看答案及解析
-
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl—、CO32-、OH—这6种子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
A.Cu2+、H+、Cl— B.K+、CO32-、OH—
C.Cl—、CO、OH— D.K+、H+、Cl—
难度: 中等查看答案及解析
-
标准状况下,使NO2和O2按4:1的体积比充满干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度为( )
A.
mol•L-1 B.
mol•L-1 C.
mol•L-1 D.
mol•L-1
难度: 中等查看答案及解析
-
硅及其化合物在材料领域中应用广泛,下列叙述中不正确的是( )
A.硅单质可用来制造太阳能电池
B.装碱性溶液的玻璃试剂瓶必能用玻璃塞
C.二氧化硅是制造光导纤维的材料
D.自然界硅元素的贮量丰富,并存在大量的单质硅
难度: 中等查看答案及解析
-
下列离子方程式的书写中,正确的是( )
A.硫酸氢钾和氢氧化钡按等物质的量在溶液中反应:Ba2++OH-+H++SO42-=BaSO4↓+2H2O
B.碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++CO2↑+2H2O
C.过量二氧化碳跟苛性钾反应:CO2+2OH—=CO32—+H2O
D.钠跟水反应: Na+2H2O=Na++2OH—+H2↑
难度: 中等查看答案及解析
-
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目明显减少的是( )
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
难度: 中等查看答案及解析
-
向两烧杯中分别加入等量的铝与等物质的量的浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为( )
A.1:2 B.3:2 C3:1 D.6:1
难度: 中等查看答案及解析
-
下列装置不能达到实验目的的是( )
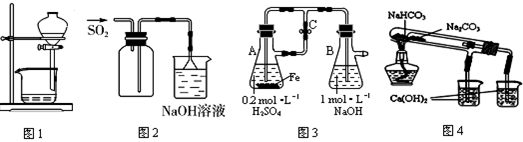
A.图1用于放出碘的四氯化碳溶液
B.图2用于实验室用于实验室收集SO2
C.图3用于实验室制备Fe(OH)2
D.图4用于比较NaHCO3和Na2CO3热稳定性
难度: 中等查看答案及解析
-
硫代硫酸钠(Na2S2O3)可作为还原剂,已知25.0mL 0.0100mol/L的Na2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化为( )
A.S2- B.S C.SO32- D.SO42-
难度: 中等查看答案及解析