-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL难度: 中等查看答案及解析
-
下列溶液加热蒸干、灼烧后,能析出原溶质固体的是( )
A.AlCl3
B.KHCO3
C.Fe2(SO4)3
D.NH4HCO3难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
A.②④⑥
B.①②
C.②③⑤
D.②④⑤⑥难度: 中等查看答案及解析
-
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应难度: 中等查看答案及解析
-
向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
A.AgCl的溶解度增大
B.AgCl的溶解度、Ksp均增大
C.Ksp(AgCl)增大
D.AgCl的溶解度、Ksp均不变难度: 中等查看答案及解析
-
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,是该碱溶液的pH等于( )
A.9.0
B.9.5
C.10.5
D.11.0难度: 中等查看答案及解析
-
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A.a mL
B.(50-a)mL
C.大于(50-a)mL
D.大于a mL难度: 中等查看答案及解析
-
反应:A+3B⇌2C+D,在四种不同情况下的反应速率分别为:
①
②
③
④
该反应进行得最快的是( )
A.①
B.④
C.①④
D.②③难度: 中等查看答案及解析
-
下列反应在常温下均为非自发反应,则在高温下仍为非自发的是( )
A.2CO(g)═2 C(s)+O2(g)
B.2CuO(s)═Cu2O(s)+O2(g)
C.MgCO3(s)═MgO(s)+CO2(g)
D.SnO2(s)+C(s)═Sn(s)+CO2(g)难度: 中等查看答案及解析
-
下列物质的稀溶液中,溶质的阴、阳离子个数之比为1:2的是( )
A.Na2HPO4
B.NaHSO4
C.(NH4)2SO4
D.K2S难度: 中等查看答案及解析
-
关于小苏打水溶液的表述正确的是( )
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有:NaHCO3═Na++HCO3-,HCO3-═H++CO32-,H2O⇌H++OH-难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是( )
A.2mol C
B.2mol A、1mol B和1mol He(不参加反应)
C.1mol B和1mol C
D.2mol A、2mol B和3mol C难度: 中等查看答案及解析
-
对于反应N2+O2⇌2NO在密闭容器中进行,下列哪个条件不能加快化学反应速率( )
A.缩小体积使压强增大
B.体积不变充入N2使压强增大
C.体积不变充入 He使压强增大
D.升高温度难度: 中等查看答案及解析
-
一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)
2SO3(g),进行到4min时,测得n (SO2)=0.4mol,若反应进行到前2min末时,容器中n (SO2)为( )
A.1.6mol
B.1.2mol
C.大于1.6mol
D.小于1.2mol难度: 中等查看答案及解析
-
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液的洗涤油污能力强;
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸钡不能做“钡餐”而硫酸钡则能;
⑤泡沫灭火器灭火的原理.
A.②③④
B.①②③
C.③④⑤
D.①②③④⑤难度: 中等查看答案及解析
-
用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时( )
A.醋酸和氢氧化钠物质的量相等
B.醋酸和氢氧化钠恰好中和
C.氢氧化钠过量
D.醋酸有剩余难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.
B.
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量难度: 中等查看答案及解析
-
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol•L-1与Bmol•L-1,则A和B的关系为( )
A.A>B
B.A=10-4B
C.B=10-4A
D.A=B难度: 中等查看答案及解析
-
CaCO3在下列液体中溶解度最大的是( )
A.H2O
B.Na2CO3溶液
C.CaCl2溶液
D.乙醇难度: 中等查看答案及解析
-
含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为Va、Vb,则两者的关系正确的是( )
A.Va>10Vb
B.Va=10Vb
C.Vb<10Va
D.Vb>10Va难度: 中等查看答案及解析
-
下列溶液,一定呈中性的是( )
A.c(H+)=1×10-7mol/L的溶液
B.pH=pOH 的溶液
C.pH=14-pOH 的溶液
D.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液难度: 中等查看答案及解析
-
得到较纯的FeS沉淀,应在FeCl2溶液中加入的试剂( )
A.(NH4)2S
B.Na2S
C.H2S
D.NaHS难度: 中等查看答案及解析
-
实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录难度: 中等查看答案及解析
-
常温下,0.1mol/L某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
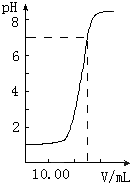
A.盐酸起始浓度为0.1mol•L-1
B.NaOH溶液浓度为0.08mol•L-1
C.滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色
D.滴到中和点时,耗NaOH物质的量为0.002mol难度: 中等查看答案及解析