-
下列说法正确的是 ( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.放热反应的反应速率总是大于吸热反应的反应速率
C.增大压强会加快化学反应速率,其原因是增加了活化分子的百分率
D.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
难度: 简单查看答案及解析
-
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
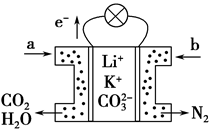
A.a为CH4,b为CO2
B.CO32-向负极移动
C.此电池在常温时也能工作
D.正极电极反应式为O2+2H2O+4e-=== 4OH-
难度: 简单查看答案及解析
-
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.
H2SO4(aq)+
Ba(OH)2(aq)===
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
难度: 简单查看答案及解析
-
图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸。下列说法正确的是( )
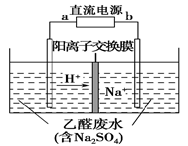
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+
D.电解过程中,阴、阳极还分别产生少量的O2和H2
难度: 简单查看答案及解析
-
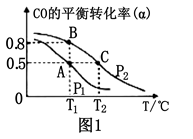
已知反应:A(s)+3B(g)
2C(g)ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示:下列说法正确的是( )

A.前4 min,用A表示反应速率为v(A)=0.005mol/(L·min)
B.X曲线表示B的物质的量随时间变化的关系
C.第t1 min时说明反应达到了平衡
D.第10 min时,可能采取了降温
难度: 简单查看答案及解析
-
下列不能用勒夏特列原理解释的是 ( )
①盛满二氧化氮的烧瓶浸入热水中颜色变深 ②新制的氯水在光照条件下颜色变浅 ③在H2、I2(g)和HI组成的平衡体系中,加压,混合气体颜色变深 ④饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 ⑤高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 ⑥加催化剂有利于氨氧化反应 ⑦500℃左右比室温更有利于合成氨的反应 ⑧收集氯气用排饱和食盐水的方法 ⑨可用浓氨水和氢氧化钠固体快速制取氨气
A.②③⑤⑥ B.③⑤⑥⑨ C.③⑤⑥⑦ D.④⑥⑦⑨
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
难度: 简单查看答案及解析
-
反应aM(g)+bN(g)
cP(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z 表示反应开始时N的物质的量与M的物质的量之比。下列说法不正确的是( )

A.同温同压同z时,加入催化剂,平衡时Q的体积分数不改变
B.同温同压时,增加z,平衡时Q的体积分数一定增加
C.同温同z时,增加压强,平衡时Q的体积分数一定减小
D.同压同z时,升高温度,平衡时Q的体积分数一定增加
难度: 困难查看答案及解析
-
下列说法中正确的是( )
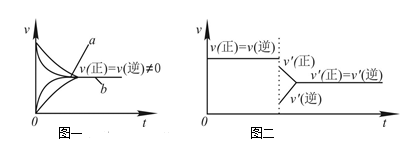
A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动
B.若在恒容容器中发生反应:N2+3H2
2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动
C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示
D.若在恒压容器中发生反应:2SO3
2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示
难度: 困难查看答案及解析
-
一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:2A(g)
B(g)+C(g)
容器
编号
温度 (℃)
起始物质的量(mol)
平衡物质的量(mol)
A(g)
B(g)
C(g)
Ⅰ
387
0. 20
0. 080
0. 080
Ⅱ
387
0. 40
Ⅲ
207
0. 20
0. 090
0. 090
下列说法不正确的是( )
A. 该反应的正反应为放热反应
B. 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同
C. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短
D. 若起始时向容器Ⅰ中充入0.15 mol A、0.15 mol B和0.10 mol C则反应将向逆反应方向进行
难度: 困难查看答案及解析
-
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)
2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
容器
甲
乙
丙
相关条件
恒温恒容
绝热恒容
恒温恒压
反应物投料
1mol A2、3mol B2
2mol AB3
2mol AB3
平衡时容器体积
V甲
V乙
V丙
反应的平衡常数K=
K甲
K乙
K丙
平衡时AB3的浓度/mol·L-1
c甲
c乙
c丙
平衡时AB3的反应速率/mol·L-1·min-1
v甲
v乙
v丙
下列说法正确的是 ( ) ( )
A.v甲=v丙 B.c乙>c甲 C.V甲>V丙 D.K乙<K丙
难度: 困难查看答案及解析
-
某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。电源接通后,向乙中滴入酚酞试液,在F极附近显红色。下列说法不正确的是 ( )

A.电源B 极的名称是负极
B.甲装置中电解反应的总化学方程式是: CuSO4+Fe
Cu+ FeSO4
C.设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是1:1
D.设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L
难度: 困难查看答案及解析
-
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2 (g)+3Y2(g)
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
容器编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
X2
Y2
XY3
①
1
3
0
放热46.3 kJ
②
0.8
2.4
0.4
Q(Q>0)
下列叙述不正确的是 ( )
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.相同温度下;起始时向容器中充入1.0 X2 mol 、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆)
D.容器①、②中反应的平衡常数相等,K=
难度: 困难查看答案及解析
-
某恒温密闭容器发生可逆反应:Z(?)+W(?)
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
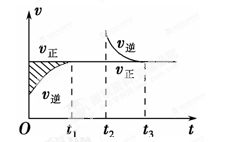
A.Z和W在该条件下均为非气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的X浓度不相等
D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
难度: 困难查看答案及解析
-
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
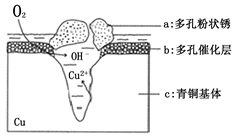
A.腐蚀过程中,负极是c
B.正极反应是 O2 + 4e- +2H2O = 4OH-
C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况)
D.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
难度: 中等查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)
CO2(g)+H2(g),ΔH<0。现有三个相同的2L恒
容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I中CO 的物质的量比容器II中的多
C.容器I、III中反应的平衡常数相同
D.容器I中CO 的转化率与容器II中CO2 的转化率之和等于1
难度: 困难查看答案及解析