-
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A. 它是副族元素 B. 它是第六周期元素
C. 它的原子核内有63个质子 D. 它的一种同位素的核内有89个中子
难度: 中等查看答案及解析
-
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是( )
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的沸点为H2T<H2R
B. 单质与稀盐酸反应的速率为L<Q
C. M与T形成的化合物具有两性
D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
下列关于元素周期表的说法正确的是( )
A. 元素周期表有7个周期,8个主族 B. 元素周期表有18个纵行,共16个族
C. 短周期元素中可能有副族元素 D. 元素周期表中的过渡元素就是副族元素
难度: 简单查看答案及解析
-
下列实验中,不能观察到明显变化的是( )
A.把一块打磨过的镁带放入少量冷水中
B.把氯气通入FeCl2的溶液中
C.把绿豆大的钾投入水中
D.把溴水滴加到KI淀粉溶液中
难度: 简单查看答案及解析
-
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
难度: 中等查看答案及解析
-
下列有关环境问题的说法不正确的是( )
A. 正常雨水的pH为7.0,pH小于7.0的雨水为酸雨
B. 严格执行机动车尾气排放标准有利于防止大气污染
C. 食用二氧化硫和某些含硫化合物增白过的食品对人体健康产生损害
D. 使用氯气对自来水消毒过程中,产生的有机氯化物可能对人体有害
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 甲烷的分子式:CH3 B. 高氯酸的分子式:HClO4
C. 氯原子的结构示意图:
D. 中子数为146、质子数为92 的铀(U)原子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子
C. 标准状况下,11.2LCO2与足量Na2O2反应转移的电子数为0.5 NA
D. 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
雷雨天闪电时空气中有O3生成。下列说法正确的是( )
A. O2和O3互为同位素
B. O2和O3的相互转化是物理变化
C. 等质量的O2和O3含有相同的质子数
D. 在相同温度和压强下,等体积的O2和O3含有相同的原子数
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 通过化学变化可以实现16O与18O间的相互转化
B. HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C. 碱性强弱:KOH<NaOH<LiOH
D. 元素周期律是元素原子核外电子排布周期性变化的结果
难度: 中等查看答案及解析
-
在溶液中能大量共存的一组离子或分子是( )
A. NH4+、H+、NO3-、Fe2+ B. K+ 、Al3+、SO42-- 、NH3·H2O
C. Na+、K+、SO32-、Cl2 D. Na+ 、Cl-、CO32-、OH-
难度: 中等查看答案及解析
-
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
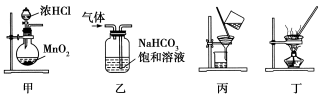
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成盐,由此可知( )
W
X
Y
Z
A. 元素非金属性X强于Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X、Y、Z中最简单氢化物稳定性最强的是Y
D. Z元素单质在化学反应中只表现氧化性
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是( )
A. 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO-
B. 水玻璃在空气中变质:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3↓
C. 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO
+6H++5H2O2=2Mn2++5O2↑+8H2O
难度: 中等查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子组成HmX分子,在ag HmX 中所含质子的物质的量是
A.
(A-N+m)mol B.
(A-N)mol
C.
( A-N)mol D.
(A-N+m)mol
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 第ⅠA 族元素的金属性比第ⅡA 族元素的金属性强
B. 第ⅦA 族元素单质的熔点从上到下逐渐升高
C. 第ⅥA 族元素的氢化物中,稳定性最好的元素非金属性最弱
D. 第三周期元素的离子半径从左到右逐渐减小
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
向苏打和小苏打溶液中分别滴入少许稀盐酸
均冒气泡
两者均能与盐酸反应
B
向Al2(SO4)3溶液中滴加过量氨水
溶液澄清
Al(OH)3是两性氢氧化物
C
将可调高度的铜丝伸入到稀HNO3中
溶液变蓝
Cu与稀HNO3发生置换反应
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、M是元素周期表中前20号主族元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是( )
A. YX2、M2Y都是电解质
B. Z元素的最高价氧化物的水化物的化学式为HZO4
C. 氢化物的还原性:X >Y >Z
D. 简单离子的半径:M >Z >Y >X
难度: 中等查看答案及解析
