-
化学源于生活,用于生活,下列过程不涉及化学变化的是
A. 用小苏打治疗胃酸过多 B. 用氯气对自来水进行消毒
C. 食盐撒在积雪上,加快积雪的融化 D. 用肥皂水涂抹被蚊虫叮咬的伤口
难度: 简单查看答案及解析
-
“绿色化学”有助于解决环境污染问题,下列做法不符合“绿色化学”理念的是
A. 因地制宜,大力发展风力发电
B. 废旧电池集中回收,并填埋处理
C. 大力发展公共交通,提倡绿色出行
D. 使用可降解塑料,减少“白色污染”
难度: 中等查看答案及解析
-
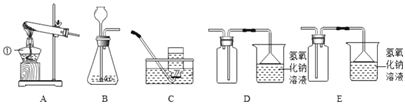
下列实验操作错误的是
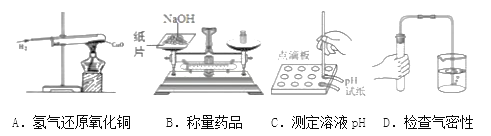
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
取一滤纸条,等间距滴10滴紫色石蕊溶液,然后装入玻璃管中(如图所示),两端管口同时放入分别蘸有浓氨水和浓盐酸的棉球,几秒后观察到图示现象。下列说法不正确的是
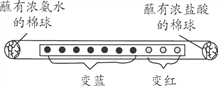
A. 氨水的pH大于7
B. 所有分子的运动速率都相等
C. 氨分子和氯化氢分子在不断运动
D. 酸、碱能使酸碱指示剂显示不同颜色
难度: 中等查看答案及解析
-
推理是一种重要的学习方法,下列推理正确的是
A.化学变化都遵循质量守恒定律,所以质量不发生改变的变化就是化学变化
B.化合物是由多种元素组成的纯净物,所以由多种元素组成的纯净物一定是化合物
C.离子是带电的原子或原子团,所以带电的粒子就是离子
D.碱能使酚酞试液变红,所以能使酚酞试液变红的物质一定是碱
难度: 中等查看答案及解析
-
下列实验中利用提供的方案不能达到目的的是
选项
实验目的
实验方案
A
除去铁粉中混有的少量银粉
用足量稀盐酸溶解后过滤
B
鉴别纯羊毛织品和涤纶织品
取样灼烧后闻气味
C
鉴别石灰水与氢氧化钠溶液
分别通入CO2观察现象
D
电解水时,为了加快反应速度
向水中加入稀硫酸或氢氧化钠
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
十氢化萘,一种有机化合物,有毒;主要用作油脂、树脂、橡胶等的溶剂和除漆剂、润滑剂,是一种重要的化工原料,其化学式C10H18,下列说法正确的是 ( )
A. 1个十氢化萘分子含有10个碳原子和9个氢分子
B. 十氢化萘的相对分子量为138g
C. 十氢化萘中碳元素的质量分数为13%
D. 十氢化萘由碳元素和氢元素组成
难度: 简单查看答案及解析
-
a、b两种物质的溶解度曲线如图所示.下列说法不正确的是
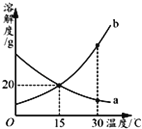
A. 15℃时,a、b的溶解度均为20g
B. 加水或升温均可使b的饱和溶液变为不饱和溶液
C. 将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D. 20℃时分别向100g水中加入20ga和b,升温至30℃,所得溶液均为饱和溶液
难度: 中等查看答案及解析
-
有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种。取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,产生沉淀的质量与加入盐酸体积的关系如图所示。由此推断白色粉末的成分是( )
A. 可能有 BaCl2 B. 可能有Na2SO4
C. 肯定只有Na2CO3 D. 肯定有K2SO4、Na2CO3、BaCl2,没有CuSO4
难度: 简单查看答案及解析
-
有关CuSO4制备途径及性质如图所示:
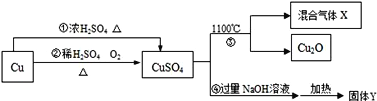
已知:(1)Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O (2)难溶性碱受热会分解为金属氧化物和水(3)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.下列说法不正确的是
A. 途径②比途径①更好地体现绿色化学思 B. 生成等质量的硫酸铜,途径①中消耗硫酸的质量多
C. 反应③分解所得混合气体X的成分是SO2和SO3 D. 固体Y为CuO
难度: 中等查看答案及解析