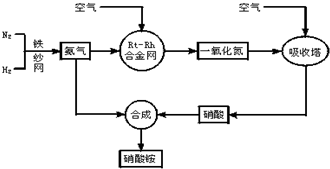
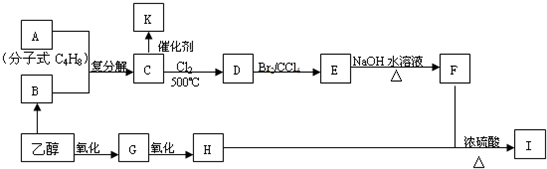
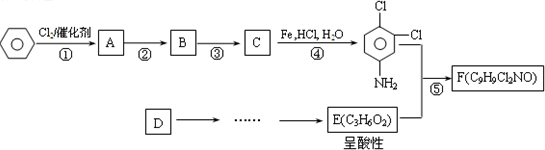
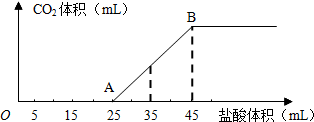
-
设NA表示阿伏加德罗常数,下列说法中不正确的是( )
A.一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4•5H2O晶体中含有0.5NA个Cu2+难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1L3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.石油裂解可以得到氯乙烯
B.油脂水解可得到氨基酸和甘油
C.所有烷烃和蛋白质中都存在碳碳单键
D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖难度: 中等查看答案及解析
-
离子检验的常用方法有三种:
下列离子检验的方法不合理的是( )检验方法 沉淀法 显色法 气体法 含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气体产生
A.NH4+:气体法
B.I-:沉淀法
C.Fe3+:显色法
D.Ca2+:气体法难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是( )
A.0.1mol•L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1L0.1mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-)
C.0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断不正确的是( )
A.氧化性:ClO->I2>SO42-
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D.次氯酸钠可以与亚硫酸钠共存难度: 中等查看答案及解析
-
现有三组实验:①除去混在植物油中的水 ②回收碘的CCl4溶液中的CCl4 ③用食用酒精浸泡中草药提取其中的有效成份.分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液难度: 中等查看答案及解析
-
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Na2O2和C18O2反应的产物碳酸钠,它的相对分子质量为110
B.1molAl和足量的NaOH溶液充分反应时,同时有1molH2O参加
C.反应Cu+H2SO4→CuSO4+H2↑,在一定条件下也能实现
D.常见自来水的杀菌消毒剂有:Cl2、Ca(ClO)2、ClO2、Na2FeO4等,效果最好的是Cl2难度: 中等查看答案及解析
-
用石墨作电极电解AlCl3溶液时,下列图象合理的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )

A.始祖鸟烯与乙烯互为同系物
B.若R1=R2=-CH3,则其化学式为C12H16
C.若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种
D.始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的难度: 中等查看答案及解析
-
有下列离子晶体空间结构示意图:●为阳离子,○为阴离子.以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为( )
A.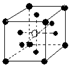
B.
C.
D.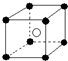
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.聚丙烯的结构简式为:
B.石英的化学式为:CaSiO3
C.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
D.Ar原子的结构示意图为:难度: 中等查看答案及解析
-
下列化合物中,按沸点由高到低顺序排列正确的是 ( )
①②
③
A.③②①
B.②③①
C.①②③
D.③①②难度: 中等查看答案及解析
-
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
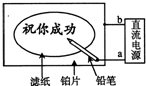
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极难度: 中等查看答案及解析
-
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入240mL 4mol/L的稀硝酸,恰好使混合物完全溶解.放出2.688L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.42mol
B.0.21mol
C.0.16mol
D.0.14mol难度: 中等查看答案及解析
-
下列离子反应方程式正确的是( )
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O难度: 中等查看答案及解析
-
下列说法正确的是( )
A.化学式符合XOH(X代表某一元素)的物质一定是碱
B.分子式为C6H6的物质一定是苯
C.最简单的烯烃一定是乙烯
D.含碳量最高的烃一定是乙炔难度: 中等查看答案及解析
-
在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.CCO
CO2
Na2CO3
B.CuCu(NO3)2 溶液
Cu(OH)
C.FeFe2O3
Fe2(SO4)3溶液
D.CaOCa(OH)2溶液
NaOH溶
难度: 中等查看答案及解析
-
常温下,下列溶液中一定能大量共存的离子组是( )
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是( )
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①>②>③
D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL难度: 中等查看答案及解析