-
若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是( )
A. 该元素原子处于能量最低状态时,原子中共有3个未成对电子
B. 该元素原子核外共有5个电子层
C. 该元素原子的M能层共有8个电子
D. 该元素原子最外层共有3个电子
难度: 中等查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
表述Ⅰ
表述Ⅱ
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比PbH4分子稳定性高
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小
C
在形成化合物时,同一主族元素的化合价相同
同一主族元素原子的最外层电子数相同
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
2007年9月,美国科学家宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现,有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上面所述中“结合力”的实质是( )
A.分子间作用力 B.氢键 C.非极性共价键 D.极性共价键
难度: 简单查看答案及解析
-
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①④⑥⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
难度: 困难查看答案及解析
-
下列各组原子中,彼此的化学性质一定相似的是 ( )
A. P原子:1s2;Q原子:2s2
B. P原子:M能层上有2个电子;Q原子:N能层上有2个电子
C. P原子:2p能级上有1个未成对电子;Q原子:3p能级上也有1个未成对电子
D. P原子:最外层L能层上只有一个空轨道;Q原子:最外层M能层上也只有一个空轨道
难度: 中等查看答案及解析
-
最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法不正确的是
A.羰基硫属于极性分子
B.羰基硫的电子式为:
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子处于同一直线上
难度: 简单查看答案及解析
-
Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol 配合物与足量AgNO3溶液作用生成1 mol AgCl沉淀,则m、n的值是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=3,n=3
难度: 中等查看答案及解析
-
下表列出了前20号元素中的某些元素性质的有关数据

下列有关叙述正确的是
A. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧
B. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最
外层为8电子稳定结构的物质可能是PCl5和CCl4
C. 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族
D. 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式
难度: 困难查看答案及解析
-
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是 ( )
A. 硅烷分子中Si—H键的极性和HF中H—F的极性
B. 乙烯CH2=CH2中碳碳σ键的键能和碳碳π键的键能
C. 1molCO2晶体C=O键数目和1molSiO2晶体Si—O键数目
D. N2中的分子间作用力和CO中的分子间作用力
难度: 中等查看答案及解析
-
下列排列顺序正确的是
①热稳定性:Ca(HCO3)2>NaHCO3>CaCO3>Na2CO3②还原性:S2->SO32->I->Fe2+> Br->Cl-
③氧化性:Fe3+> Cu2+> H+> Fe2+>Zn2+>Mg2+ ④结合H+的能力:OH->AlO2->CO32-> HCO3-
>CH3COO -
⑤酸性:H2SiO3>H2CO3>H2SO4>HClO4 ⑥溶解度:CaSO4>CaCO3, Ca(NO3)2>Ca(OH)2
A. ①②③④ B. ①③④⑤ C. ②④⑤⑥ D. ②③④⑥
难度: 困难查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. XZ2、X2M2、W2Z2均为直线型的共价化合物
C. 由X元素形成的单质不一定是原子晶体
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
下列说法正确的是


A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2 周围最近且等距离的CO2有8个
D.图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果
难度: 中等查看答案及解析
-
金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为
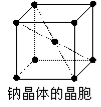
A.
B.
C.
D.
难度: 中等查看答案及解析
-
国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如右图),有关说法正确的是( )

A.锰价电子排布为3d74s0
B.Bi是d区金属
C.该晶体的化学式为MnBi
D.该合金堆积方式是简单立方
难度: 简单查看答案及解析
-
M元素的一个原子失去两个电子转移到R元素的两个原子中去,形成离子
化合物。下列四种化合物都符合条件,但从结构上看,有一种物质与其它三种明显
不同,该物质是( )
A. FeS2 B. CaC2 C. BaO2 D. MgCl2
难度: 中等查看答案及解析
-
某固体仅由一种元素组成,其密度为5.0 g·cm-3。用X射线研究该固体的结构时得知:在边长为10-7 cm的正方体中含有20个原子,则此元素的相对原子质量最接近于下列数据中的( )。
A.32 B.120 C.150 D.180
难度: 中等查看答案及解析
-
二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
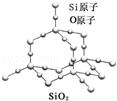
A. 晶体中Si、O原子个数比为1:2
B. 晶体中Si、O原子最外层都满足8电子结构
C. 晶体中一个硅原子含有Si﹣O键数目为4
D. 晶体中最小环上的原子数为6
难度: 中等查看答案及解析
-
已知在晶体中仍保持一定几何形状的最小单位称为晶胞。干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子。实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
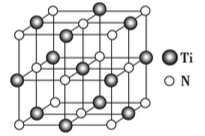
下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
难度: 困难查看答案及解析
-
下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体
尽可能采取紧密堆积方式,以使其变得比较稳定
⑦干冰晶体中,一个CO2分子周围有8个CO2分子紧邻
A.①②③ B.②③④ C.④⑤⑥ D.②③⑦
难度: 困难查看答案及解析



 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。