-
化学与生产、生活息息相关,下列说法不正确的是( )
A.误食重金属盐可立即喝鲜牛奶或鸡蛋清解毒
B.硅是人类将太阳能转换为电能的常用材料
C.Al(OH)3可用来治疗胃酸过多,其原因是发生了氧化还原反应
D.高铁酸钾(K2FeO4)是新型高效多功能水处理剂,既能消毒杀菌又能净水
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.中子数为18的氯原子可表示为18Cl
B.盐酸和食醋既是化合物又是酸
C、可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去
D.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.将Al条投入NaOH溶液中:Al+OH-+H2O===AlO2-+H2↑
B.铜溶于稀硝酸中:Cu+4H++2NO3-===Cu2++2NO2↑+2H2O
C.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-===CaCO3↓+H2O
D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+CH3COOH===CH3COO-+HCO
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是 ( )

A.四种元素的简单氢化物都为极性分子
B.最高价氧化物对应的水化物的酸性W比Z弱
C.Z的单质与氢气反应较Y剧烈
D.X、Y形成的化合物都易溶于水
难度: 简单查看答案及解析
-
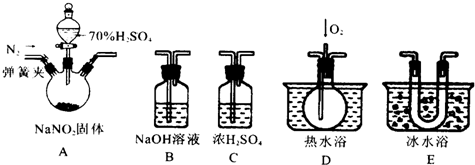
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四幅图(夹持装置未画出),判断下列说法正确的是 ( )

A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色
难度: 困难查看答案及解析
-
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )

①可以使酸性高锰酸钾溶液褪色
②可以和NaOH溶液反应
③在一定条件下可以和乙酸发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以和新制Cu(OH)2反应
A.①②③ B.①②③④ C.①②③⑤ D.①②④⑤
难度: 中等查看答案及解析
-
常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是 ( )
A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7,则该溶液的pH一定为14-a
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+)
难度: 中等查看答案及解析