-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末和氯化钠。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
难度: 中等查看答案及解析
-
“神舟七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,则对相同物质的量的这三种物质的下列说法正确的是( )
A.质子数之比为1:2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
难度: 中等查看答案及解析
-
下列物质的分类依据正确的是( )
物质类别
分类依据
A
酸
电离时能否产生氢离子
B
碱性氧化物
是否属于金属氧化物
C
胶体
能否发生丁达尔现象
D
强电解质
在水溶液中或熔化状态下能否完全电离
难度: 中等查看答案及解析
-
已知氢元素有1H、 2H、3H三种同位素,氯元素有35Cl 、37Cl两种同位素。由这五种微粒构成的HCl分子中,其相对分子质量可能有( )
A、1种 B、5种 C、6种 D、7种
难度: 中等查看答案及解析
-
下列关于实验安全说法正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.蒸馏操作时,应使温度计水银球靠近蒸馏
烧瓶支管口处
C.实验室可用燃着的酒精灯去点燃另一只酒精灯
D.将含硫酸的废液倒入水槽,用水冲入下水道
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.1 mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
C.在标准状况下,22.4 L H2和8 g 氦气均含有NA个分子
D.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个
难度: 困难查看答案及解析
-
下列实验操作正确的是( )
A.分液时,分液漏斗内上层液体从上口倒出,下层液体从下口倒出
B.过滤时,为加快过滤速度,应用玻璃棒不断搅拌
C.对于互溶的且沸点相差较大的两种液体,可使用蒸馏的方法分离
D.将硫酸铜晶体置于蒸发皿中加热,令其失去结晶水
难度: 简单查看答案及解析
-
与100mL0.1mol/L Na2SO4溶液中Na+离子浓度相同的是( )
A.10mL 1mol/L Na2SO4溶液 B.50mL 0.2mol/L NaCl溶液
C.10mL0.2mol/L Na2SO4溶液 D.200mL 0.1mol/L NaNO3溶液
难度: 中等查看答案及解析
-
对于某些离子的检验及结论中一定正确的是( )
A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中大量含有CO32-
B.加入稀盐酸和氯化钡溶液,有白色沉淀产生,则原溶液中一定含有SO42-
C.分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开
D.加硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,则原溶液中一定有Cl-
难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是( )
A.碳酸钙和稀盐酸反应: CaCO3+2H+=Ca2++CO2↑+H2O
B.硫酸铵溶液与氢氧化钡溶液反应:NH4++OH-= NH3·H2O
C.CO2通入足量澄清石灰水中 CO2+Ca2++2OH-=CaCO3↓+H2O
D.CuO与盐酸反应:CuO+2H+=Cu2++H2O
难度: 中等查看答案及解析
-
欲配制下列四种无色透明的酸性溶液,其中能配制成功的是( )
A.NH4+、NO3-、Al3+、Cl- B.Na+、CH3COO-、K+、NO3-
C.MnO4-、K+、SO42-、Na+ D.Ca2+、Mg2+、HCO3-、CO32-
难度: 中等查看答案及解析
-
在体积相同的两个密闭容器中分别充满NO2、N2O4气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B.两种气体N原子为1:2
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
难度: 中等查看答案及解析
-
下列实验操作中正确的是( )
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3
次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在外面,应将滴管尖嘴处伸入试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸
片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘
难度: 中等查看答案及解析
-
配制250 mL0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )
A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容
B. 在容量瓶中进行定容时仰视刻度线
C. 在容量瓶中进行定容时俯视刻度线
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
难度: 中等查看答案及解析
-
在标准状况下,将w g A气体(摩尔质量为M g/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
下列现象或应用不能用胶体的知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.氯化钙溶液中加入碳酸钠溶液会出现白色沉淀
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.江河入海口形成三角洲
难度: 中等查看答案及解析
-
下列叙述错误的是 ( )
A.标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4
B.常温常压下,11.2LO3中所含氧原子个数等于1.5NA
C.同温、同压下,相同体积的N2和CO气体具有
相同的分子数和相同的密度
D.同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11
难度: 中等查看答案及解析
-
“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③④ C.②③⑤ D.①③④⑥
难度: 简单查看答案及解析
-
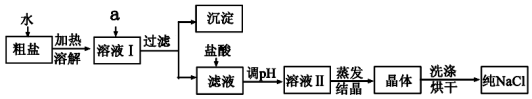
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )
物质
杂质
除杂试剂或操作方法
A.
CuSO4
FeSO4
加入过量铁粉,过滤
B.
NaNO3
CaCO3
溶解、过滤
C.
NaCl溶液
I2
加酒精,萃取分液
D.
KNO3溶液
AgNO3
加入NaCl溶液,过滤
难度: 中等查看答案及解析
-
下列每组反应一定能用同一离子方程式表示的是( )
A.CuO分别与稀硫酸、稀盐酸反应
B.Ca
CO3、Na2CO3分别与盐酸反应
C.H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应
D.Na、Mg分别与稀盐酸反应
难度: 中等查看答案及解析
-
下列离子方程式中只能表示一个化学反应的是( )
①Ag++Cl-=AgCl↓ ②Fe+Cu2+=Fe2++Cu ③CaCO3+2H+=CO2↑+H2O+Ca2+
④Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O ⑤Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓
A.①③ B.⑤ C.④⑤ D.②
难度: 中等查看答案及解析
-
要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们( )
A.溶解、过滤
B.制成热的硝酸钾饱和溶液,降温后再过滤
C.制成溶液后直接蒸干
D.先溶解、再蒸发结晶,趁热过滤
难度: 简单查看答案及解析
-
实验室需用2mol·L-1硫酸铜溶液450 mL,配制时应称取的固体质量是( )
A.144.0 g CuSO4 B.144.0 g CuSO4·5H2O
C.225.0 g CuSO4·5H2O D.250.0 g CuSO4·5H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.100 mL3 mol·L-1的硫酸与100 mL H2O混合,硫酸物质的量浓度变为1.5 mol·L-1
B.把100 g 20%的NaCl溶液与100 g H2O混合后,NaCl溶液的质量分数是10%
C.把200 mL3 mol·L-1的BaCl2溶液与100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D.把100 mL 20%的NaOH溶液与100 mL H2O混合后,NaOH溶液的质量分数是10%
难度: 中等查看答案及解析
-
在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度、压强均相同)。则混合气体中CO和CO2的分子个数比为( )
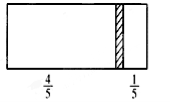
A.1:1 B.1:3
C.3:1 D.2:1
难度: 中等查看答案及解析