-
下列做法不能体现低碳生活的是
A.减少食物加工过程 B.注意节约用电
C.尽量购买本地的、当季的食物 D.大量使用薪柴为燃料
难度: 简单查看答案及解析
-
下列关于胶体的叙述不正确的是
A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液区别开来
B.光线透过胶体时,会发生丁达尔效应
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
难度: 简单查看答案及解析
-
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的氧气,三个反应中转移的电子数之比为
A.1:1:1 B.2:2:1 C.2:3:1 D.4:3:2
难度: 简单查看答案及解析
-
R、X、Y和Z是四种元素,它们常见化合价均为+2,且X2+与单质R不反应:X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
难度: 简单查看答案及解析
-
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
难度: 简单查看答案及解析
-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 简单查看答案及解析
-
下列实验装置(固定装置略去)和操作正确的是

难度: 简单查看答案及解析
-
能鉴别MgI2, AgNO3, Na2CO3,NaAlO2,四种溶液的试剂是
A.HNO3 B.KOH C.BaCl2 D.NaClO
难度: 简单查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
难度: 简单查看答案及解析
-
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
难度: 简单查看答案及解析
-
下图
为直流电源,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为电镀槽.接通电路后发现
上的c点显红色.为实现铁上镀铜,接通
后,使c、d两点短路.下列叙述正确的是( )

A.a为直流电源的负极 B.c极发生的反应为2H++2e-=H2↑
C.f电极为铜板 D.e极发生还原反应
难度: 简单查看答案及解析
-
下面关于SiO2晶体网状结构的叙述正确的是
A.每个Si原子周围结合2个O原子 B.SiO2是其分子式
C.1molSiO2含2molSi−O键 D.最小的环上,有6个Si原子和6个O原子
难度: 简单查看答案及解析
-
将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
难度: 简单查看答案及解析
-
下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):
①C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l);ΔH=-2878kJ/mol
②C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g);ΔH=-2658kJ/mol
③C4H10(g)+9/2O2(g)=4CO(g)+5H2O(l);ΔH=-1746kJ/mol
④C4H10(g)+9/2O2(g)=4CO(g)+5H2O(g);ΔH=-1526kJ/mol
由此判断,正丁烷的燃烧热是
A.-2878kJ/mol B.-2658kJ/mol C.-1746kJ/mol D.-1526kJ/mol
难度: 简单查看答案及解析
-
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1:4 B.1:2 C.2:1 D.4:1
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A.金属铜溶于FeCl3溶液中:Cu + Fe3+ = Cu2+ + Fe2+
B.碳酸锌溶于稀硝酸中:CO32-+ 2H+ = H2O + CO2↑
C.苯酚钠水溶液中通入少量CO2:2C6H5O- + CO2 + H2O→2C6H5OH + CO32-
D.少量Cl2通入FeI2溶液中:Cl2+ 2I- = 2C1-+ I2
难度: 简单查看答案及解析
-
下列各组离子因发生氧化还原反应而不能大量共存的是
A.H+ 、 CO32- 、AlO2- 、SO42- B.Fe3+ 、NO3- 、Mg2+ 、I-
C.Al3+ 、Cl- 、SO42- 、HCO3- D.NH4+ 、Cl- 、HCO3- 、Ca2+
难度: 简单查看答案及解析
-
测定硫酸铜晶体中结晶水含量的实验,下列四项中造成结果偏高的原因有
①坩埚用水洗后没有烘干②加热时有少量晶体溅出③把加热得到的白色粉末放在空气中冷却、称量④加热后粉末中有少量的黑色固体
A.①②③ B.①② C.②③ D.①②④
难度: 简单查看答案及解析
-
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molNN键吸收941kJ热量,则( )
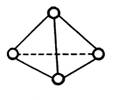
A.N4与N2互称为同位素
B.1molN4气体转化为N2时要吸收748kJ能量
C.N4是N2的同系物
D.1molN4气体转化为N2时要放出724kJ能量
难度: 简单查看答案及解析
-
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持 V1 + V2= 50mL)。下列叙述正确的是( )

A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
难度: 简单查看答案及解析
-
关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
难度: 简单查看答案及解析
-
在下列各说法中,正确的是( )
A.△H>0表示放热反应,△H < 0表示吸热反应
B.热化学方程式中的化学计量数可以是整数,也可以是分数
C.1mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
难度: 简单查看答案及解析
-
从矿物学资料查得,一定条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A.Cu2S既是氧化产物又是还原产物 B.5mol FeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物D. FeS2只作还原剂
难度: 简单查看答案及解析
-
已知
(1)H2(g)+1/2O2(g)=H2O(g); △H1=a kJ·
(2)2H2(g)+O2(g)=2H2O(g); △H2=b kJ·
(3)H2(g)+1/2O2(g)=H2O(l); △H3=c kJ·
(4)2H2(g)+O2(g)=2H2O(l); △H4=d kJ·
下列关系式中正确的是
A.a<c <0 B.b>d>0 C.b<a<0 D.d>c>0
难度: 简单查看答案及解析
-
充分利用能源、提高原子利用率、减少向环境排放废弃物等都是“绿色化学”的基本要求。① 实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加铁钉和少量稀硫酸; ② 用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银; ③接触法制硫酸的设备中安装“热交换器”和锅炉,利用余热预热冷原料气和蒸气发电; ④工业合成氨中分离产物得到氢气和氮气再循环使用。上述主要不是从“绿色化学”角度考虑的是( )
A.只有① B.②④ C.③④ D.②③
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.碳酸氢根离子的电离方程式: HCO3-+H2O
H3O++ CO32-
B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
难度: 简单查看答案及解析
-
有关甲、乙、丙、丁四个图示的叙述正确的是( )

A.甲中负极反应式为:2H++2e-=H2↑ B.乙中阳极反应式为:Ag++e-= Ag
C.丙中H+向碳棒方向移动 D.丁中电解开始时阴极产生黄绿色气体
难度: 简单查看答案及解析
-
X、Y、Z、W有如右图所示的转化关系,且△H=△H1+△H2,则X、Y可能是( )
①C、CO ②S、SO2 ③AlCl3、Al(OH)3
④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤ C.①③④ D.①②③
难度: 简单查看答案及解析
-
右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。下列有关说法正确的是( )
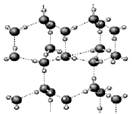
A.冰晶体熔化时,水分子之间的空隙增大
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
D.冰晶体中每个水分子与另外四个水分子形成四面体
难度: 简单查看答案及解析