-
设NA为阿佛加德罗常数,下列说法正确的是( )
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1L 2mol/L的MgCl2溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA
A.①②③④ B.③④ C.①③④ D.①②③⑤
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.能电离出H+的化合物叫做酸
B.实验测得1mol某气体体积为22.4L,测定条件一定是标准状况
C.虽然SO2的水溶液能导电,但SO2不是电解质
D.有单质参加的化学反应一定是氧化还原反应
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应 OH-+H+= H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+= Ca2+ + 2H2O
C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2+ + Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2
难度: 简单查看答案及解析
-
在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+ 、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、 K+、Cl-、 NO3- D.Fe3+、K+、SO42-、Cl-
难度: 简单查看答案及解析
-
某溶液中含有Fe2+和I -。为了氧化I -而不使Fe2+被氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
A.FeCl2 B.KMnO4 C.Cl2 D.FeCl3
难度: 简单查看答案及解析
-
水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等。下列方法中也可以用来进行海水淡化的是( )
A.过滤法 B.蒸馏法 C.分液法 D.冰冻法
难度: 简单查看答案及解析
-
下列溶液中溶质的物质的量浓度为1mol/L的是( )
A.将58.5gNaCl溶解在1L水中
B.将1L10mol/L的浓盐酸加入9L水中
C.将22.4LHCl气体溶于水配成1L溶液
D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL
难度: 简单查看答案及解析
-
下列说法正确的是

A.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
B.可以采用蒸发浓缩、冷却结晶的方法从硝酸钾溶液中获得硝酸钾晶体
C.将乙醇与水分离,如图1、图2操作
D.稀释浓H2SO4,如图3操作
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,0.1molCl2溶于水,Cl2与水发生反应转移的电子数目为0.1NA
B.常温常压下,0.2molAl与足量NaOH溶液反应,转移电子数为0.6 NA
C.常温常压下,500 mL 0.1mol/L醋酸溶液中含有分子的总数目为0.05NA
D.常温常压下,16g CH4与18 g NH4+所含质子数相等
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A. 含金属元素的离子一定都是阳离子
B. 现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是

难度: 简单查看答案及解析
-
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是
物质
杂质
除杂试剂或操作方法
①
酒精
水
蒸馏
②
H2
CO2
通过盛有NaOH溶液洗气瓶,再通过盛有浓硫酸洗气瓶
③
NaNO3
CaCO3
溶解、过滤、蒸发
④
NaCl
I2
加热
⑤
KNO3溶液
AgNO3
加入NaCl溶液,过滤
A. ① ④ ⑤ B. ③ ④ ⑤ C. ① ② ③ ④ D. ① ② ③ ⑤
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.惰性电极电解氯化钠溶液:2Cl- +2 H2O
Cl2 ↑+H2 ↑+2OH—
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+CO32- +2H2O
D.向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H+=Fe3++3H2O
难度: 简单查看答案及解析
-
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为
B.1 mol该氯原子的质量为aNA g
C.m g该氯原子的物质的量为
mol
D.n g该氯原子所含的电子数为
难度: 简单查看答案及解析
-
下列示意图与对应的反应情况正确的是
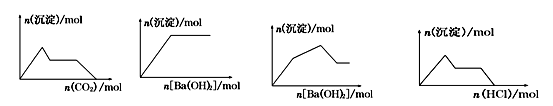
A B C D
A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.NaHSO4溶液中逐滴加入Ba(OH)2溶液
C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D.NaAlO2溶液中逐滴加入盐酸
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.在无色溶液中:
、Cu2+、
、
B.在含Fe3+的溶液中:
、Na+、Cl-、OH-
C.在强碱溶液中:Na+、K+、Cl-、
D.在强酸性的溶液中:K+、Na+、Cl-、
难度: 简单查看答案及解析
-
配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是( )
A.未冷却即转移、定容
B.容量瓶中原有少量蒸馏水
C.定容时俯视刻度线
D.摇匀后溶液倒入试剂瓶时,试剂瓶中原有少量水
难度: 简单查看答案及解析
-
下列关于氧化物的叙述中,正确的是 ( )
A.酸性氧化物都能与水化合生成酸
B.碱性氧化物都能与水化合生成碱
C.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
D.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式的是( )
A.碳酸钙和盐酸反应:CO
+2H+
H2O+CO2↑
B.铜片插入硝酸银溶液中:Cu + Ag+=Cu2+ + Ag
C.向稀硫酸溶液中加铁:3Fe+6H+
3Fe3++3H2↑
D.氧化镁与稀硝酸混合: MgO+2H+=Mg2++H2O
难度: 简单查看答案及解析
-
下列有关实验用品的使用或操作的叙述中,正确的是( )
A.用红色石蕊试纸检验溶液的酸性
B.称量NaOH固体时,将NaOH直接放在托盘中的纸片上
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
D.容量瓶用于配制一定体积、一定浓度的溶液,不能作为反应容器使用
难度: 简单查看答案及解析
