-
NA为阿伏加德罗常数的数值,下列说法中正确的是
A. 标准状况下,14g氮气含有的核外电子数为5NA
B. 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
C. 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA
D. 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
难度: 中等查看答案及解析
-
实验是化学研究的基础。下列关于各实验装置的叙述正确的是
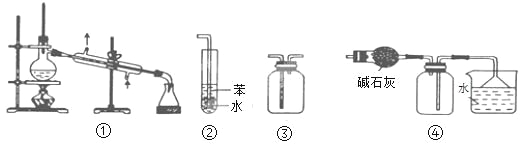
A. 装置③可用于收集H2、CO2、Cl2、NH3等气体
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置①常用于分离互不相溶的液体混合物
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A. HCl B. Cl2 C. NaHCO3 D. CO2
难度: 简单查看答案及解析
-
在下列三个反应中:①SO2+2NaOH=Na2SO3+H2O ②SO2+2H2S=3S↓+2H2O
③SO2+Cl2+2H2O=H2SO4+2HCl 二氧化硫所起的作用( )
A. 相同 B. 不同 C. 均是氧化剂的作用 D. 均是还原剂作用
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.碳酸氢钠的热稳定性比碳酸钠的强
B.等质量的碳酸钠、碳酸氢钠分别与足量的盐酸反应,前者产生的二氧化碳多
C.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生的二氧化碳一样多
D.等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,前者消耗的盐酸多
难度: 中等查看答案及解析
-
能够用于鉴别二氧化硫和二氧化碳的溶液是( )
A. 澄清的石灰水 B. 品红溶液 C. 紫色石蕊试液 D. BaCl2溶液
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.浓硫酸能与铜反应释放出氢气
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
难度: 中等查看答案及解析
-
下列过程中不属于氮的固定的是( )
A.工业合成氨
B.雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐
C.用氨气与硝酸制成“硝铵”化肥
D.豆科作物的根瘤菌将空气中的氮转化为氨
难度: 中等查看答案及解析
-
常温下,在水溶液中发生如下反应:①16H++10C-+2XO
===2X2++5C2+8H2O;②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是( )
A. 反应C2+2A2+===2A3++2C-可以进行
B. 反应③是置换反应
C. 氧化性由强到弱的顺序是XO
>C2>B2>A3+
D. 还原性由强到弱的顺序是C->A2+>B->X2+
难度: 困难查看答案及解析
-
、
、
、H+、H2是
A. 氢的五种同位素 B. 包的五种同素异形体
C. 五种核素 D. 氢元素的五种不同微粒
难度: 中等查看答案及解析
-
已知R2+核外有a个电子,b个中子。正确表示R原子符号的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
是常规核裂变产物之一,可以通过测定大气或水中它的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的叙述中错误的是
A.
的化学性质与
相同 B.
的原子序数为53
C.
的原子核外电子数为78 D.
的原子核内中子数多于质子数
难度: 中等查看答案及解析
-
已知R2+核内共有N个中子,R的质量数为A,mgR2+中含电子的物质的量为
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
与元素的化学性质关系最密切的是
A. 中子数 B. 电子数 C. 最外层电子数 D. 核外电子层数
难度: 简单查看答案及解析
-
下列结构示意图所代表的微粒中,最难发生化学反应的是
A.
B.
C.
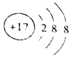 D.
D. 
难度: 中等查看答案及解析
-
下列说法中肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
难度: 中等查看答案及解析
-
下列说法正确的是
A. 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B. 最外层电子达稳定结构的微粒只能是稀有气体的原子
C. F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
D. NH4+与OH-具有相同的质子数和电子数
难度: 中等查看答案及解析
-
某核素原子核内质子数为m,中子数为n,则下列叙述中正确的是
A. 不能由此确定该元素的相对原子质量
B. 这种元素的相对原子质量为m+n
C. 若碳原子质量为ωg,则此原子的质量为(m+n)ωg
D. 核内中子的总质量小于质子的总质量
难度: 简单查看答案及解析
-
下列说法不正确的是
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中于数决定
③同位素的化学性质几乎相同
④质子数相同、电子数也相同的两种微粒,不可能一种是分子另一种是离子
⑤Cl2中35Cl与37Cl两种核素的个数之比与HCl中35Cl与37Cl的个数之比相等
A. ③ B. ④ C. ②⑤ D. ①
难度: 困难查看答案及解析
-
下列反应的离子方程式正确的是( )
A.钠与水的反应:2Na+2H+=2Na++H2↑
B.铜与浓硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
C.铜与硝酸银溶液反应:Cu+Ag+=Ag+Cu2+
D.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色溶液中:Al3+、Cl-、MnO4-、SO42-
B. 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN-
C. Fe2+、NO3-、Cl-、Na-
D. H+、HCO3-、Ca2+、Cl-
难度: 中等查看答案及解析
-
将3.2g铜跟30mL1mol/L的硝酸充分反应,还原产物有NO和NO2,反应后的溶液中有amolH+,则此时溶液中含有NO3-的物质的量为
A. 0.5amol B. (0.1+a)mol C. 0.1amol D. 2amol
难度: 中等查看答案及解析
-
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价砷(As)元素,但它对人体是无毒的。砒霜的成分是As2O3,属剧毒物质,吃饭时同时大量食用海鲜和青菜,容易中毒,专家给出的公式:大量海鲜+大量维生素C = 砒霜。下面有关解释不正确的是( )
A. 维生素C能将+5价砷氧化成As2O3 B. 维生素C具有还原性
C. 致人中毒过程中+5价砷发生还原反应 D. 青菜中含有维生素C
难度: 简单查看答案及解析
-
下列实验操作正确的是
A. 蒸发时,将蒸发皿放置在铁架台的铁圈上直接用酒精灯外焰加热
B. 蒸馏时,温度计水银球浸入蒸馏烧瓶内液面下,冷凝水从冷凝管下口进
C. 萃取时,分别用两个烧杯从下口接收有机层和水层
D. 配制100ml 0.100 mol/L的硫酸铜溶液时,可将2.50克胆矾溶于100mL蒸馏水中
难度: 中等查看答案及解析
-
如图是气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是( )

A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升,试管中黄绿色褪去
B.若水槽中是水(并滴有酚酞),试管中是NH3,可看到液面上升并呈红色
C.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管
D.若水槽中和试管中都是氯水,光照后可在试管中收集到氧气
难度: 困难查看答案及解析
-
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
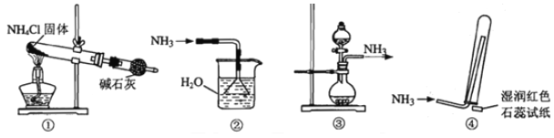
A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收集、检验装置
难度: 中等查看答案及解析