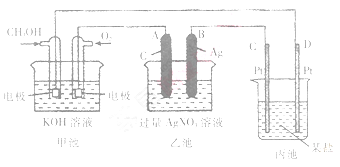
-
下列说法中正确的是
A.石油分馏、煤的干馏均是物理变化
B.PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
C.可利用清洁能源如太阳能、潮汐能、风能来发电
D.铅蓄电池、锂电池、碱性锌锰干电池都属于二次电池
难度: 简单查看答案及解析
-
下列说法中错误的是
A.在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积相同
B.相对分子质量相同的两种物质一定是同分异构体
C.C2H6和C4H10一定是同系物
D.烯烃各同系物中碳的质量分数都相等
难度: 中等查看答案及解析
-
下列叙述正确的是
A.c(H+)等于l×l0-7mol/L的溶液一定是中性溶液
B.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其Kw= l×l0-14
C.将水加热,Kw增大,pH不变
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是
A.当△H为“一”时,表示该反应为吸热反应
B.已知C(s)+
O2(g)
CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
C.反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小
D.反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
难度: 中等查看答案及解析
-
在密闭容器中,对于反应2SO2(g)+O2(g)
2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为
A. 10 mol和 10% B. 20 mol和 80% C. 20 mol和 40% D. 20 mol和 20%
难度: 困难查看答案及解析
-
下列物质的制取,实验操作正确的是
A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体
B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸于,可制取NH4HCO3固体
C.向FeCl3饱和溶液中缓慢滴入过量氨水加热,可制取Fe(OH)3胶体
D.向电石中缓慢滴入饱和食盐水,可制取C2H2
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,
D.混合溶液中,
难度: 中等查看答案及解析
-
下列说法正确的是
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
难度: 简单查看答案及解析
-
物质的量浓度相同的下列物质中,含粒子种类最多的是
A.CaCl2 B.CH3COONa C.K2S D.NH3
难度: 中等查看答案及解析
-
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
难度: 中等查看答案及解析
-
分子式为C5H12的烃,其分子内含3个甲基,该烃的二氯代物的同分异构体的数目为
A.8种 B.9种 C.10种 D.11种
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c (H+)=1 ×10
mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c (Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
D.c (H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列说法中正确的是
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转变为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
难度: 简单查看答案及解析
-
近年来流行喝苹果醋。苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸(
一羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:
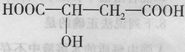
下列相关说法正确的是
A.苹果酸在一定条件下能发生消去反应
B.苹果酸在一定条件下能催化氧化生成醛
C.苹果酸在一定条件下能发生加聚反应生成高分子化合物
D.l mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3
难度: 中等查看答案及解析
-
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2═4Fe(OH)3
B.2Fe+2H2O+O2═2Fe(OH)2
C.2H2O+O2+4e-═4OH-
D.Fe-3e-═Fe3+
难度: 简单查看答案及解析
-
下列溶液中离子浓度大小关系错误的是
A.0.1 mol/L的NH4Cl溶液中:
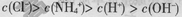
B. 0.1mol/L的CH3COONa溶液中:
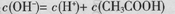
C. 0.1 mol/LNa2S的溶液中:

D.pH=2的盐酸与pH=12的氨水等体积混合后:
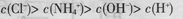
难度: 中等查看答案及解析
-
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25
时:

在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:

B.当V=20 mL时,溶液中:

C.当V=20 mL时,溶液中:

D.当v>0时,溶液中一定存在

难度: 中等查看答案及解析
-
关于下列各图的叙述,正确的是


A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ/mol
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1
升温至t2
时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
难度: 中等查看答案及解析
-
某研究性学习小组进行电化学实验,研究装置如图所示。
有关说法不正确的是
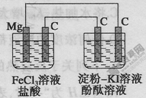
A.镁为负极
B.原电池中碳极的电极反应式为Fe3++e-=Fe2+
C.电解池中阳极处先变红
D.电解池中阴极的电极反应式为2H++2e-=H2↑
难度: 中等查看答案及解析
-
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。)
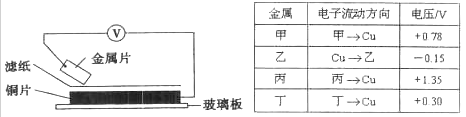
依据记录数据判断,下列结论中正确的是
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
难度: 中等查看答案及解析
-
下列有关除杂质(括号中为杂质)的操作中,错误的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.乙醇(水):加入足量生石灰,蒸馏,收集馏出物
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
难度: 中等查看答案及解析