-
化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A. 铁轨的锈蚀 B.铁粉、生石灰用于袋装食品的防腐及防潮
C. 枪支保存时涂层黄油防锈蚀 D.消防员戴着防毒面具(内装 Na2O2)救火
难度: 中等查看答案及解析
-
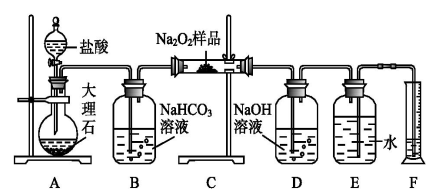
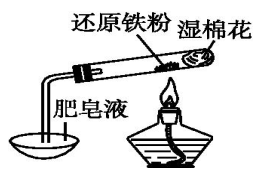
用下列装置进行相应实验,不能达到实验目的的是

A. 图 1 所示装置可用于制备氢氧化亚铁
B. 图 2 所示装置可用于测定 Na2CO3 和 NaHCO3 混合物中 NaHCO3 的含量
C. 图 3 所示装置可用于检验氨气溶于水后显碱性
D. 图 4 所示装置可用于 CaCO3 和稀盐酸反应制取少量的 CO2 气体
难度: 中等查看答案及解析
-
下列现象或技术应用中与胶体无关的是 ( )
A.在饱和氯化铁溶液中滴加入 NaOH 溶液,产生红褐色沉淀
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
难度: 简单查看答案及解析
-
NA 为阿伏加德罗常数,下列说法不正确的是( )
A. 58.5 克 NaCl 中,Na+最外层电子数为 8NA
B. Na2O、Na2O2 中阴阳离子个数均为 1:2
C. 标准状况下11.2升Cl2 与足量Fe充分反应转移NA个电子
D. 2.7克Al分别与足量稀盐酸和足量NaOH溶液反应,生成氢气质量不相等
难度: 简单查看答案及解析
-
吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断 Na2SeO3 的作用是
A.作氧化剂 B.作还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
B.硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
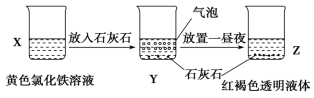
A.利用过滤的方法,可将Z中固体与液体分离
B. X、Z 烧杯中分散质相同
C. Y 中反应的离子方程式可能为: 3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+
D. Z 中分散系能产生丁达尔效应
难度: 中等查看答案及解析
-
将铁粉、铜粉、 FeCl3 溶液和 CuCl2 溶液混合在试管中充分反应,若过滤后滤渣能被磁铁吸引,则下列有关叙述正确的是( )
A.溶液中肯定不存在的离子只有 Cu2+ B. Fe3+和 Cu2+均能被铁粉还原
C.滤液中滴加 KSCN 溶液显红色 D.滤渣中肯定不含有铜
难度: 简单查看答案及解析
-
将0.4gNaOH 和 1.06g Na2CO3混合并配成溶液, 向溶液中滴加 0.1mol·L-1稀盐酸。 下列图像能正确表示加入盐酸的体积和生成 CO2的物质的量的关系的是( )

难度: 中等查看答案及解析
-
下列是某兴趣小组根据教材实验设计的一个能说明 Na2CO3 和 NaHCO3 热稳定性的套管实验。请观察如图所示实验装置并研究实验原理,其中分析错误的是( )

A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.整个实验过程中都没有发现 A 烧杯的澄清石灰水变浑浊
D.加热不久就能看到 A 烧杯的澄清石灰水变浑浊
难度: 中等查看答案及解析
-
在Al2(SO4)3 和MgSO4 的混合溶液中,滴加NaOH 溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中 Al2(SO4)3 与MgSO4 的物质的量浓度之比为( )
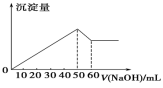
A. 1∶2 B. 2∶1 C. 6∶1 D. 3∶1
难度: 困难查看答案及解析
-
在含有Fe2+、Fe3+、Al3+、NH4+的稀溶液中加入Na2O2固体,充分作用后,再加入过量稀盐酸完全反应,则离子数目没有明显变化的是( )
A. Fe2+ B. Fe3+ C. Al3+ D.NH4+
难度: 中等查看答案及解析
-
按图装置持续通人气体 X,并在管口 P 处点燃,实验结果使澄清石灰水变浑浊,则 X、 Y 不可能是( )

A. H2 和 NaHCO3 B. CO 和 Fe2O3 C. CO 和 CuO D. CO 和 Al2O3
难度: 困难查看答案及解析
-
将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.最终出现灰绿色沉淀 D.无变化
难度: 中等查看答案及解析
-
下述实验设计或操作正确的是( )
选项
实验目的
实验设计
A
除去铝箔上少量的氧化膜
将铝箔放入 NaOH 溶液中洗涤
B
排水法收集 KMnO4 分解产生的 O2
先熄灭酒精灯,后移出导管
C
检验溶液中是否含有 Fe2+
向溶液中滴入氯水后,再滴加 KSCN 溶液
D
证明 H2SO4 酸性比 H2CO3 强
把稀 H2SO4 滴入 NaHCO3 溶液
难度: 中等查看答案及解析
-
下面有关 Na2CO3 与 NaHCO3 的叙述错误的是( )
A. Na2CO3 遇少量盐酸可转化为 NaHCO3
B.在水中的溶解度 Na2CO3 比 NaHCO3 大
C.与同浓度稀盐酸反应 Na2CO3 比 NaHCO3 剧烈
D. NaHCO3 与 Ca(OH)2 溶液混合会产生白色沉淀
难度: 中等查看答案及解析
-
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,则下列说法正确的是( )
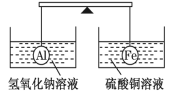
A.两烧杯中均无气泡产生 B.去掉两烧杯,杠杆右端下沉
C.去掉两烧杯,杠杆仍平衡 D.左边烧杯中的溶液质量减少了
难度: 中等查看答案及解析
-
Fe和Fe2O3混合物共27.2g,加入200mL 稀 H2SO4,收集到标准状况下2.24LH2, 所得溶液中滴加 KSCN 溶液,不变色。为中和过量的H2SO4,并使溶液中的金属阳离子全部转化为沉淀,共消耗了3 mol/L 的NaOH 溶液400 mL,则该H2SO4 的物质的量浓度为( )
A. 0.5mol/L B. 2mol/L C. 2.25mol/L D. 3mol/L
难度: 简单查看答案及解析
-
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法不正确的是
A. 最终得到的溶液中: c(NaAlO2):c(NaCl) =2:3
B. 最终得到7.8g沉淀
C. 标准状况下,反应过程中共生成8.96 L气体
D. 最终得到的溶液中: c(Na+)=2.0 mol·L-1
难度: 困难查看答案及解析
-
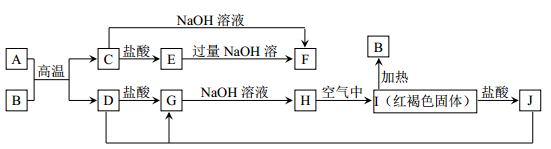
已知:(1)NH4++OH-=NH3↑+H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO(2)微溶物在溶液中不能大量存在,会沉淀而析出某强酸性的X 溶液中可能含有 Fe2+、 A13+、 NH4+、 CO32―、 SO32―、 SO42―、 C1―中的若干种,现取 X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是A13+和C1―
难度: 困难查看答案及解析