-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
A. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果,因为乙烯能与高锰酸钾发生氧化还原反应
B. 用Na2S除去废水中的Cu2+和Hg2+,因为Na2S具有强还原性
C. 用氧化铁制作红色涂料,因为氧化铁能与酸反应
D. 用明矾溶液清除铜镜表面的铜锈,因为明矾溶液中Al3+能与铜锈反应
难度: 中等查看答案及解析
-
下列实验操作不能达到其对应目的是( )
编号
实验操作
目的
A
取4gNaOH加入96mL水中(水的密度近似看作1g/cm3)
配制4%的NaOH溶液
B
配制一定物质的量浓度的溶液实验中,用蒸馆水润洗容量瓶
避免造成误差,且不会使所配制溶液浓度偏低
C
向CH3COONa溶液中滴入酚酞溶液,加热
证明升高温度能促进CH3COONa 水解
D
向盛有铜片的试管中加入浓硫酸,加热
证明浓硫酸具有强氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.3NA
B. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C. 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA
D. 标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.将铝片加入烧碱溶液中:2Al + 2OH- = 2AlO2- + H2↑
B.用两个铜片作电极电解盐酸:Cu + 2H+ H2↑ + Cu2+
C.向FeI2溶液中滴加少量氯水:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
D.Na2S溶液呈碱性:S2-+ 2H2O
H2S + 2OH-
难度: 中等查看答案及解析
-
某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和C3H8O。下列说法错误的是( )
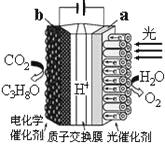
A. 该装置将光能和电能转化为化学能
B. 该装置工作时,H+从a极区向b极区迁移
C. 每还原44 g CO2,理论上可生成33.6L O2
D. b电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
难度: 困难查看答案及解析
-
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
A. 原子半径:Z>R>W
B. 气态氢化物稳定性:HmW>HnR
C. XW4分子中各原子均满足8电子结构
D. Y、Z、R三种元素组成的化合物水溶液一定显碱性
难度: 中等查看答案及解析
-
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 醋酸的电离平衡常数:B点>A点
B. 由水电离出的c(OH-):B点>C点
C. 从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D. 从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析

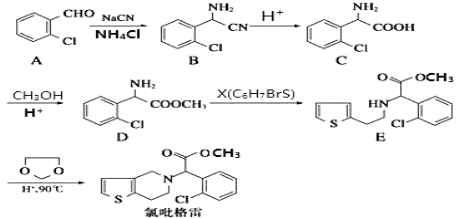
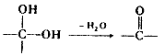 ②
②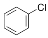 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(