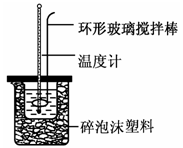
-
纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是
A.大于 B.等于 C.小于 D.不能肯定
难度: 简单查看答案及解析
-
关于化学反应与能量的说法正确的是
A.中和反应是吸热反应 B.燃烧属于放热反应
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol /(L·s) B.υ(B)= 0.3 mol /(L·s)
C.υ(C)= 48 mol /(L·min) D.υ(D)= 1 mol /(L·s)
难度: 简单查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3mol/L B.Y2为0.4mol/L
C.X2为0.2mol/L D.Z为0.4mol/L
难度: 简单查看答案及解析
-
可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
难度: 简单查看答案及解析
-
有甲、乙两醋酸稀溶液,测得甲的PH=2,乙的pH=3,下列推断中正确的是
A.物质的量浓度C(甲)=C(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲.乙两酸的体积V(乙)=10V(甲)
D.甲中的C(OH-)为乙中C(OH-)的10倍
难度: 简单查看答案及解析
-
恒温时,固定容积的容器内发生如下反应:2NO2(g)
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
A.不变 B.增大 C.减小 D.无法判断
难度: 简单查看答案及解析
-
同体积的pH=3的强酸溶液和弱酸溶液分别跟等质量的镁充分反应,下列错误的
A.刚开始时两种溶液中产生H2的速率相同
B.若有一种溶液中镁有剩余,则有剩余的是强酸溶液
C.若两种溶液中镁均无剩余,则两者产生等量的氢气
D.若两种溶液中镁均有剩余,则两者产生等量的氢气
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+ H2O
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)
CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深
C.升高温度能够增大硝酸钾在水中的溶解度
D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
难度: 中等查看答案及解析
-
下列说法正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol H2SO4和1mol Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
合成氨的反应是:N2(g)+3H2(g)
2NH3(g);△H<0。使产率增大的方法是
A.升高温度 B.降低压强 C.使用催化剂 D.及时分离出NH3
难度: 简单查看答案及解析
-
钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2→TiCl4
Ti
已知:①C(s)+O2(g)=CO2(g) ,ΔH1
②2CO(g)+O2(g)=2CO2(g) ,ΔH2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ,ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH为
A.ΔH3+2ΔH1+2ΔH2 B.ΔH3+2ΔH1+ΔH2
C.ΔH3+2ΔH1-ΔH2 D.ΔH3+2ΔH1-2ΔH2
难度: 中等查看答案及解析
-
通常人们把拆开1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键
A—A
B—B
A—B
生成1 mol化学键时放出的能量
436 kJ·mol-1
243 kJ·mol-1
431 kJ·mol-1
则下列热化学方程式不正确的是( )
A.
A2(g)+
B2(g)=AB(g) ΔH=-91.5 kJ·mol -1
B.A2(g)+B2(g)=2AB(g) ΔH=-183 kJ·mol -1
C.
A2(g)+
B2=AB(g) ΔH=+91.5 kJ·mol-1
D.2AB(g)=A2(g)+B2(g) ΔH=+183 kJ·mol-1
难度: 中等查看答案及解析
-
右图是关于反应A2(g)+3B2(g)
2C(g) ⊿H<的平衡移动图象,影响平衡移动的原因可能是
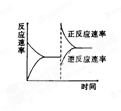
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态的是
A.混合气体的密度 B.混合气体的总物质的量
C.混合气体的压强 D.混合气体的总体积
难度: 中等查看答案及解析
-
在373K时,N2O4
2NO2 △H>0把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为50%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
难度: 困难查看答案及解析
-
向一定体积的0.1摩/升的醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是
A.溶液的pH值变小
B.醋酸的电离度增大
C.溶液的导电能力减弱
D.中和此溶液所需的0.1摩/升NaOH溶液的体积增加
难度: 中等查看答案及解析
-
在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g)
cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6 mol/L,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4 mol/L,下列叙述中正确的是
A.a+b>c+d
B.平衡向右移动
C.重新达平衡时,A气体浓度增大
D.重新达平衡时,D的体积分数减小
难度: 中等查看答案及解析