-
化学与生产、生活密切相关。下列叙述中,正确的是( )
A.制作计算机芯片的材料是SiO2晶体,84消毒液的有效成分是NaClO
B.水在4℃时主要以(H2O)2存在,两个水分子间可能以某种特殊的分子间作用力相结合
C.0.2摩尔铝和足量氢氧化钠溶液反应,参加还原反应的水是3.6克
D.SO2和CO2都能使雨水的pH < 5.6,造成酸雨
难度: 中等查看答案及解析
-
下列有关的化学用语中正确的是( )
A.氮分子的电子式:
B.氮原子电子排布式:1s22s22p5
C.氮分子的结构式:
D.氧原子最外层轨道表示式:
难度: 中等查看答案及解析
-
下列物质间关系判断正确的是( )
A.1H2、2H2 ——同位素
B.O2-、O22-——同素异形体
C.HCOOCH3、CH3OCHO ——同分异构体
D.HCOOH、C15H31COOH ——同系物
难度: 中等查看答案及解析
-
工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)( )
A.溴苯(溴):加NaOH溶液,分液
B.MgCl2溶液(Fe3+):加MgO固体,过滤
C.乙酸(水):加新制生石灰,蒸馏
D.硬脂酸(油酸):催化加氢
难度: 中等查看答案及解析
-
能说明氯的非金属性比溴强的事实是( )
①共用电子对偏移程度:H-Cl > H-Br ②酸性:HClO4 > HBrO4
③热稳定性:HCl > HBr ④酸性:HCl <HBr
A.①②③ B. ①②④ C.②③④ D.②③
难度: 中等查看答案及解析
-
阿佛加德罗常数用NA表示,下列叙述正确的是( )
A.室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+
B.常温常压下,46g NO2含有的原子数小于3NA
C. 12g石墨含有4NA个自由移动的电子
D.1mol LiAlH4在125℃完全分解成LiH、H2、Al,转移电子3NA
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.乙醇与浓硫酸170℃共热,制得的气体直接通入溴水,可检验制得的气体是否为乙烯
B.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率
C.将(NH4)2Fe(SO4)2·6H2O溶于稀硝酸,滴加KSCN溶液出现血红色,说明试样已变质
D.由ⅠA族和ⅦA族的元素形成的离子晶体,晶体的结构完全相同
难度: 中等查看答案及解析
-
已知H2(g)+ Br2(l)→ 2HBr(g)+ 42 kJ。1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:
H2(g)
Br2(g)
HBr(g)
1 mol 分子中的化学键断裂时需要吸收的能量/kJ
436
a
369
则上述表格中的a值为( )
A、404 B、344 C、230 D、200
难度: 中等查看答案及解析
-
、气体制备装置中不能“随开随制,随关随停”的是( )
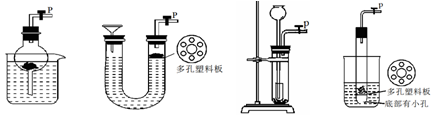
A. B. C. D.
难度: 中等查看答案及解析
-
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应; ②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应; ④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应; ⑥过量的铜与浓硫酸在加热条件下反应
A.②③④⑥ B.②④⑤⑥ C.①②④⑤ D.③④⑤⑥
难度: 中等查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法错误的是( )
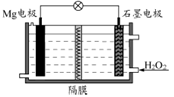
A.Mg 电极是该电池的负极
B.溶液中Cl-向石墨电极移动
C.该装置中电子从Mg电极流向石墨电极
D.H2O2 在石墨电极上发生还原反应
难度: 中等查看答案及解析
-
某可逆反应aA + bB
cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
A.写成2aA + 2bB
2cC,Q值、K值均扩大了一倍
B.写成2aA + 2bB
2cC,Q值扩大了一倍,K值保持不变
C.写成cC
aA + bB,Q值、K值变为原来的相反数
D.写成cC
aA + bB,Q值变为原来的相反数,K值变为倒数
难度: 中等查看答案及解析
-
在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。右图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
难度: 困难查看答案及解析
-
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是( )
A.Al3+、Mg2+、SO32- B.Mg2+、CO32-、I-
C.Al3+、SO32-、I- D.Al3+、Br-、SO32-
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A、足量的CO2通入饱和碳酸钠溶液中: CO2+CO32-+H2O→2HCO3-
B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O
4Fe3++4OH-
C、次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+
D、碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO3-+2Ca2++4OH— ®2CaCO3↓+ Mg(OH)2↓+ 2H2O
难度: 中等查看答案及解析
-
在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是( )
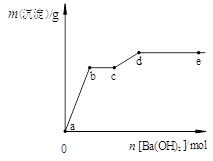
A、a→b时的沉淀的成分为BaSO4与Mg(OH)2
B、b→c时发生的离子反应为:H+ + OH— → H2O
C、c→d时离子的物质的量:Ba2+ 可能大于Cl—
D、d→e时离子的物质的量:Ba2+ 一定大于OH—
难度: 中等查看答案及解析
-
某溶液中含有大量的Cl一、Br一、I一,若向l L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为( )

A、5:15:4 B、5:12:4 C、15 : 30 : 8 D、条件不足,无法计算
难度: 中等查看答案及解析
-
下列物质久置于空气中因被氧化而变质且有明显颜色改变的是( )
A.KMnO4 B.CuSO4 C.FeSO4•7H2O D.C6H5OH
难度: 中等查看答案及解析
-
测定Cu(NO3)2∙nH2O的结晶水含量,下列方案中不可行的是( )
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→冷却→称量Cu(NO3)2
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
难度: 中等查看答案及解析
-
已知芳香烃A、B的结构模型如下图所示,相关叙述正确的是( )
A.
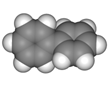 B.
B.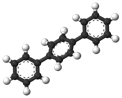
A.A的结构简式为
,其一氯代物有2种
B.A中有两种不同类型的碳碳键
C.B与A互为同系物,通式为CnH4n+2(n为苯环数)
D.与B互为同类别物质的同分异构体共有2种
难度: 中等查看答案及解析
-
25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH)
D.pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
难度: 困难查看答案及解析
-
为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是( )
A、合金中镁的质量分数为63.3%≤Mg%<100%
B、该合金中含有铝的质量至少为5.4 g
C、在产生沉淀后的溶液中一定含有0.2 mol NaAlO2
D、在产生沉淀后的溶液中有1.5 mol Na2SO4
难度: 中等查看答案及解析