-
下列叙述正确的是
A. 非金属原子间以共价键结合的物质都是共价化合物
B. 含有共价键的化合物都是共价化合物
C. 凡是能电离出离子的化合物都是离子化合物
D. 凡是含有离子键的化合物都是离子化合物
难度: 中等查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为
A. a > b > c > d B. a > c > d > b C. c > a > b .> d D. b > d > c > a
难度: 中等查看答案及解析
-
下列有关能源叙述不正确的是( )
A. 沼气是不可再生能源 B. 太阳能是新能源
C. 石油是化石燃料 D. 风能是一次能源
难度: 简单查看答案及解析
-
下列关32He的说法正确的是( )
A. 32He原子核内含有2个中子 B. 32He原子核内含有3个质子
C. 32He原子核外有3个电子 D. 32He和42He是两种不同的核素
难度: 简单查看答案及解析
-
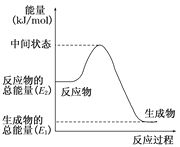
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
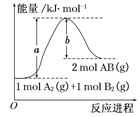
A. 每生成2分子AB吸收b kJ热量
B. 该反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1.分别向1L 0.5mol•L﹣1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应的焓变分别为△H1、△H2、△H3,下列关系正确的是( )
A. △H2>△H3>△H1 B. △H1<△H2<△H3
C. △H1>△H2=△H3 D. △H1=△H2<△H3
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1,则H2SO4和Ca(OH)2反应的中和热△H=﹣114.6kJ•mol﹣1
B. 已知CO(g)的燃烧热是283.0 kJ•mol﹣1,则2CO2(g)=2CO(g)+O2(g)△H=+566.0 kJ•mol﹣1
C. 需要加热才能发生的反应一定是吸热反应
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量就是甲烷的燃烧热
难度: 简单查看答案及解析
-
某同学为了使反应2HCl + 2Ag
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
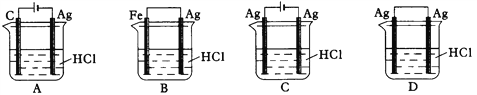
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
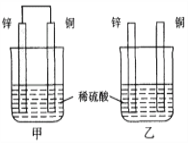
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
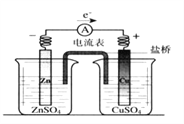
A. 铜片上有气泡逸出
B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液
D. 反应前后铜片质量不改变
难度: 简单查看答案及解析
-
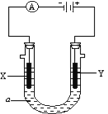
在U形管中用惰性电极电解硫酸钠和石蕊的混合液,一段时间后,可以观察到的现象是( )
A. 两极附近颜色无明显变化 B. 两极产生等量气体
C. 阳极附近的颜色变红 D. 阴极附近的颜色变红
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A. 离子的还原性:Y2->Z- B. 氢化物的稳定性:H2Y>HZ
C. 质子数:c>b D. 原子半径:X<W
难度: 简单查看答案及解析
-
用铂作电极电解某金属氯化物MCln的水溶液,当阳极产生a mol气体时,阴极析出m g金属,则金属的相对原子质量是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
难度: 简单查看答案及解析
-
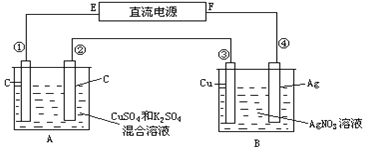
按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是( )
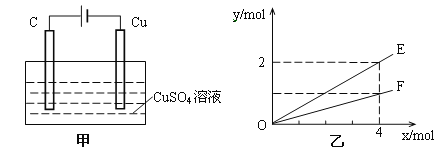
A. E表示生成铜的物质的量
B. E表示反应消耗水的物质的量
C. F表示反应生成氧气的物质的量
D. F表示生成硫酸的物质的量
难度: 中等查看答案及解析