-
水是生命之源,下列有关各种“水”的说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可以溶解Au、Pt
C.新制备的氯水中存在七种粒子
D.氨水能导电,说明氨气是电解质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,11.2LSO3所含的
分子数为0.5NA
B.12g石墨和C60的混合物中质子总数一定为6NA
C.25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子
D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
难度: 简单查看答案及解析
-
下图是某同学用500 mL容量瓶配制0.10 mol·L-1NaOH溶液的过程 ( )


该同学的错误步骤有
A. 1处 B. 2处 C. 3处 D. 4处
难度: 简单查看答案及解析
-
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因合理的是( )
①幕布的着火点升高 ②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液
难度: 简单查看答案及解析
-
金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3+ +Fe3+。下列说法正确的是
A.可用电解熔融CeO2制取金属铈,铈在阳极生成
B.
、
是同素异形体
C.铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D.铈的原子核外有58个电子
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A. X、M两种元素只能形成X2M型化合物
B. 由Y、M两种元素组成的化合物是离子化合物
C. M的简单气态氢化物的热稳定性比Z的弱
D. 原子半径:r(M)<r(W)>r(Z)<r(Y)<r(X)
难度: 简单查看答案及解析
-
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2
2PbO+2SO2;
③制粗铅:PbO+C
Pb+CO↑;PbO+CO
Pb+CO2。
下列说法正确的是( )
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子
D.将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳
难度: 中等查看答案及解析
-
如图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )
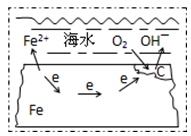
A.该金属腐蚀过程为吸氢腐蚀
B.正极为C,发生的反应为氧化反应
C.在酸性条件下发生的是吸氧腐蚀
D.正极反应为:O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.化学键的形成一定伴随着电子的转移和能量变化
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1:1
D.某晶体固态不导电水溶液能导电,说明该晶体是离子晶体
难度: 简单查看答案及解析
-
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示。下列说法不合理的是( )
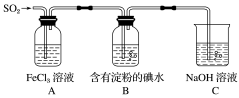
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
难度: 简单查看答案及解析
-
现向含S2-、Fe2+、Br-、I-各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是
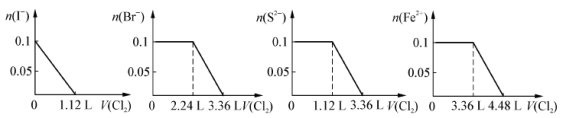
A B C D
难度: 简单查看答案及解析
-
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O
②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加N
aCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
A.①⑥⑦ B.③⑦ C.③⑤⑥ D.③⑥⑦
难度: 简单查看答案及解析
-
FeCl3
(aq)与KSCN(aq)混合时存在下列平衡:Fe3+ (aq)+ SCN—(aq)
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如下图所示,则下列说法正确的是 ( )
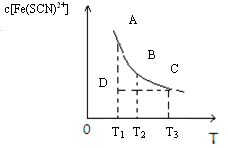
A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+ (aq)+ SCN—(aq) =Fe(SCN)2+ (aq) ΔH>0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1< K2
C.反应处于D点时,一定有V正 >V逆
D.A点与B点相比
,A点的c(Fe3+)大
难度: 简单查看答案及解析
-
工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚(2HCl+H2SeO4=H2Se
O3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
A.氧化性:H2SeO4>Cl2>H2SO3
B.酸性:H2SO4>H2SeO4
C.析出1mol硒需要消耗44.8 L SO2
D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.标准状况下2.24LCO2通入1mol•L-1100
氢氧化钠溶液中:CO2+OH-=HCO3-
B.硝酸铝溶液中加入过量氨水Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.Na2S水解:S2-+2H2O
H2S+2OH-
D.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O
难度: 简单查看答案及解析
-
臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)==N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是
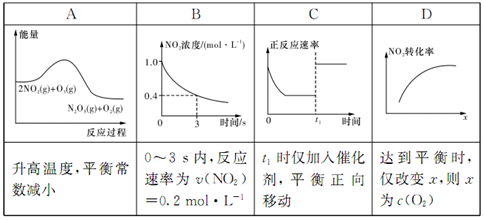
难度: 简单查看答案及解析
-
某兴趣小组设计如图所示微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1、闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )
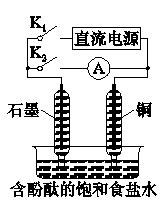
A.断开K2,闭合K1时,总反应的离子方程式为:
2H++2Cl-
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
难度: 简单查看答案及解析
-
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将甲针筒内的物质压到乙针筒内,进行实验,对乙针筒里的现象所作的判断不正确的是( )

实验序号
甲针筒内物质
乙针筒内物质
乙针筒里的现象
A
HCl
AgNO3溶液
产生白色沉淀
B
NH3
FeCl3溶液
出现红褐色沉淀
C
SO2
BaCl2
产生白色沉淀
D
Cl2
紫色石蕊溶液
先变红后褪色
难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.

判断下列说法正确的是( )
A.反应A的△H>-115.6kJ·mol-1
B.H2O中H—O键比HCl中H—Cl键弱
C.由II中的数据判断氯元素的非金属性比氧元素强
D.断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
难度: 中等查看答案及解析
-
下列实验操作能达到预期实验目的的是( )
选项
实验操作
实验目的
A
向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴84消毒液,观察红色褪色的快慢
证明随溶液pH的减少,84消毒液的氧化能力增强从而判断反应速率的大小
B
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
可证明氧化性:H2O2比Fe3+强
C[XK]
相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液
探究Cu2+、Fe3+对H2O2分解速率的影响
D
比较不同反应的反应热数据大小
从而判断反应速率的大小
难度: 中等查看答案及解析
-
某溶液除水电离出的H+、OH-之外仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种,这4种离子的物质的量均为0.1mol。若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生。下列说法错误的是 ( )
A.该溶液中肯定不含Ba2+
B.若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种
C.若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体
D.该溶液中除H+、OH-之外所含离子是Fe2+、Na
+、NO3-、SO42-
难度: 简单查看答案及解析
-
向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)⇌xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
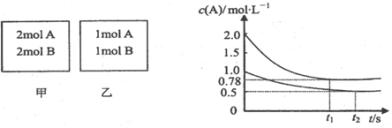
A.x可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol•L﹣1<c(A)<1.56 mol•L﹣1
难度: 简单查看答案及解析
-
下表各组物质中,不能通过一步反应实现如图所示转化的是
选项
X
Y
 Z
ZA
Fe
FeCl3
FeCl2
B
NH4Cl
NH3
NO
C
CO
CO2
D
Al2O3
AlCl3
Al(OH)3
难度: 中等查看答案及解析