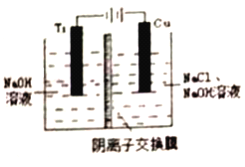
-
建设美丽中国,倡导共同行动,努力改善环境,保护家园,下列说法正确的是
A. 把硝酸工厂的烟囱建造得更高一些,以避免氮氧化物的排放
B. 推广燃煤发电,停建核电站,以防核泄漏事故发生
C. 将废电池深埋,可以避免其中的重金属污染
D. 燃煤中添加CaO,可以减少酸雨的产生
难度: 简单查看答案及解析
-
下列能级中轨道数为5的是( )
A. s能级 B. p能级 C. d能级 D. f能级
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是
A.葡萄糖在人体内氧化分解 B.氢气在氧气中燃烧
C.氢氧化钡晶体与氯化铵晶体反应 D.氢氧化钾和硫酸中和
难度: 中等查看答案及解析
-
下列物质属于弱电解质的是
A. 氯化银 B. 次氯酸 C. 氢氧化钠 D. 二氧化硫
难度: 简单查看答案及解析
-
下列说法中错误的是
A. 需要加热才能发生的反应定是吸热反应
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 化学反应中的能量变化通常表现为热量变化
D. 已知Zn与稀硫酸的反应是放热反应,则1mol Zn 与1mol H2SO4的总能最大于1molZnSO4与1mol H2的总能量
难度: 中等查看答案及解析
-
下列实验操作或对实验事实的叙述正确的是
A. 用干燥的pH试纸测定次氯酸钠溶液的pH值
B. 将FeCl3、Mg(HCO3)2溶液直接蒸干均不能得到原溶质
C. 用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液
D. 明矾可用于自来水的净化和杀菌消毒
难度: 中等查看答案及解析
-
反应C+CO2
2CO(正反应吸热) 反应速率为V1,N2+3H2
2NH3(正反应放热),反应速率为V2,对于上述反应,当温度升高时,V1、V2的变化情况为
A. 同时增大 B. 同时减小 C. V1增大,V2减小 D. V1减小,V2增大
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=7 的溶液中: Fe3+、NO3-、Cl-
B. c(H+)/c(OH-)=1×1012的溶液中: Na+、HCO3-、SO42-
C. 能使酚酞变红的溶液中: Na+、Cl-、SO42-
D. 由水电离的c(H+)=1×10-14mol /L 的溶液中: K+、NH4+、CO32-
难度: 困难查看答案及解析
-
NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用装置中a、b均为多孔石墨电极。下列说法正确的是
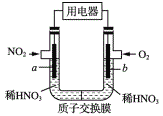
A. b为电池的负极,发生还原反应
B. 电子流向:a电极→溶液→b电极
C. 一段时间后,b极附近HNO3浓度增大
D. a极的电极反应为NO2+e-+H2O=NO3-+2H+
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
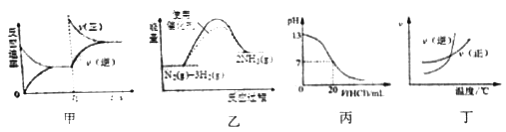
A. 图甲表示t1时刻增加反应物浓度后v(正)和v(逆)随时间的变化
B. 图乙表示反应N2(g)+3H2(g)
2NH3(g)△H<0在两种条件下物质能量随反应过程的变化
C. 图丙表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水时,溶液pH随加入盐酸体积的变化
D. 图丁表示的反应正反应是吸热反应
难度: 困难查看答案及解析
-
一定温度下,将4molNH3和5molO2充入定容密闭容器中,在催化剂存在下进行下列反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H=- 1025 kJ/mol,当达到平衡状态时,下列说法中正确的是
A. 生成4molNO B. NH3和NO物质的量之和为4mol
C. 放出1025kJ的热量 D. 平衡时容器内气体压强和开始时压强相等
难度: 简单查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO
+H2O
HCO
+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 加入少量NH4Cl固体,平衡朝正反应方向移动
C. 升高温度,
 减小
减小D. 加入NaOH固体,溶液pH减小
难度: 简单查看答案及解析
-
常温下,下列说法正确的是
A. 在0.1mol/LNa2CO3溶液中,c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
B. 1mol/LNa2CO3溶液滴加HCl溶液至c(CO32-)= c(HCO3-):c(Na+)>c(Cl-)+3c(CO32-)
C. 0.1mol/LNa2CO3溶液中通入HCl气体至pH=7:c(Cl-)>c(Na+)>c(HCO3-)
D. 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-)
难度: 困难查看答案及解析