-
下列化学用语表示正确的是
A.NaH与重水反应的方程式:NaH+D2O===NaOH+D2↑
B.三氟化氮的电子式:
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)===Na++HSO4-
D.硫化钠溶液显碱性的原因:S2-+H2O
H2S + 2OH-
难度: 简单查看答案及解析
-
设NA为的值。下列叙述正确的是
A.常温常压下,22.4 L氯气与足量NaOH溶液反应转移电子数为NA
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中氢离子数目为NA
C.4.6 g SO2、CO2混合气体中含有中子数为2.3 NA
D.1 mol CnH2n+2分子中含共价键数目为(3n+2) NA
难度: 中等查看答案及解析
-
用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO4-+C2O42-+H+
CO2↑+Mn2++___。关于此反应的叙述正确的是
A.该反应右边方框内的产物是OH-
B.配平该反应后,H+的化学计量数是8
C.该反应中氧化产物是CO2
D.该反应电子转移总数是5e-
难度: 中等查看答案及解析
-
对于反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A.只有硫酸铜作氧化剂
B.SO42-既不是氧化产物又不是还原产物
C.被氧化的硫与被还原的硫的质量比为3∶7
D.1 mol硫酸铜可以氧化
mol的硫
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+H2SO3
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑ +H2O
难度: 中等查看答案及解析
-
下列各溶液中能大量共存的离子组是
A.c(H+)=10-14 mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-
C.碳酸氢钠溶液中:K+、SO42-、Cl-、H+
D.使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+
难度: 中等查看答案及解析
-
下列说法不正确的是
A.明矾、漂白粉、臭氧的净水原理相同
B.“血液透析”的原理利用了胶体的性质
C.食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质
D.煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾
难度: 简单查看答案及解析
-
下列有关实验操作、现象、解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
用铂丝蘸取某待测液在酒精灯外焰上灼烧
火焰呈黄色
待测液不含钾元素
B
AgBr沉淀中滴入KCl溶液
有白色沉淀出现
AgCl比AgBr更难溶
C
铁丝插入稀硝酸中
有无色气体产生
生成氢气
D
向NaCN溶液中滴加无色酚酞试液
溶液变红
HCN是弱电解质
难度: 中等查看答案及解析
-
已知:①H2O(g)== =H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1
下列判断正确是
A.酒精的燃烧热ΔH=-Q3 kJ·mol-1
B.由③可知1 mol C2H5OH(g)的能量高于2 mol CO2(g)和3 mol H2O(g)的总能量
C.H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应
D.23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ
难度: 中等查看答案及解析
-
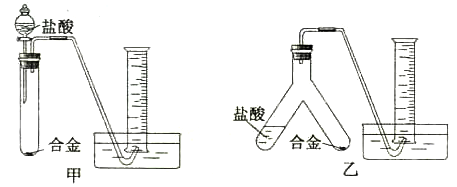
下图装置可用于
A.用氯酸钾和少量二氧化锰,制取氧气
B.用NH4Cl与Ca(OH)2,制取NH3
C.用Cu和浓HNO3反应制取NO2
D.用Cu和稀HNO3反应制NO
难度: 中等查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,得b克固体
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
难度: 中等查看答案及解析
-
用98%的浓硫酸(密度为1.84g/
)配制100inL 1 mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中使用仪器的先后顺序排列正确的是
A.④③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑥⑦ D.②⑥③⑦⑤⑥
难度: 中等查看答案及解析
-
将相同质量的两块铜片分别和浓硝酸、稀硝酸(两者均过量)反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗HNO3的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种易溶于水的物质,分别由NH、Ba2+、Mg2+、H+、OH-、Cl-、HCO、SO中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A.甲溶液含有Ba2+ B.乙溶液含有SO42-
C.丙溶液含有Cl- D.丁溶液含有Mg2+
难度: 困难查看答案及解析
-
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有
A.①②⑥ B.全部
C.①③④⑤ D.②③⑥
难度: 简单查看答案及解析
-
下列说法不正确的是
A.欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末
B.形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体
C.氯气泄漏,自救方法是用湿毛巾或蘸有纯碱水的毛巾捂住口鼻并向地势低的地方撤离
D.大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物
难度: 简单查看答案及解析