-
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A. Y原子的价层电子排布式为3s23p5 B. 稳定性:Y的氢化物>Z的氢化物
C. 第一电离能:Y<Z D. X、Y两元素形成的化合物为离子化合物
难度: 简单查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A. CH4和NH4+是等电子体,键角均为60°
B. NO3―和CO32―是等电子体,均为平面正三角形结构
C. H3O+和PCl3是等电子体,均为三角锥形结构
D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 中等查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A. sp,范德华力 B. sp2,范德华力 C. sp2,氢键 D. sp3,氢键
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3-> D-> B+> A2+ D. 单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素——
P,开创了人造核素的先河:
Al+
He→
P+
n。下列有关说法不正确的是( )
A. 该变化说明原子核在化学反应中也能发生变化
B. 该变化遵循质量守恒定律
C.
n是一种电中性粒子
D. 对于30P:原子序数=质子数=中子数=核外电子数
难度: 简单查看答案及解析
-
X2+的核外电子排布式为1s22s22p6,下列说法正确的是( )
A. X可能为稀有元素 B. X原子的核外电子排布为1s22s22p63s2
C. X原子的核外电子排布为1s22s22p62d2 D. X2+的最外电子层上有6个电子
难度: 中等查看答案及解析
-
某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
难度: 中等查看答案及解析
-
X、Y、Z三种元素的原子,其价电子排布分别为4s2、3s2 3p2 和2s2 2p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
难度: 中等查看答案及解析
-
主族元素原子失去最外层电子形成阳离子,主族元素原子得到电子填充在最外层形成阴离子。 下列各原子或离子的电子排布式错误的是( )
A. Ca2+ 1s22s22p63s23p6 B. Cr 1s22s22p63s23p63d44s2
C. Fe 1s22s22p63s23p63d64s2 D. Fe2+ 1s22s22p63s23p63d6
难度: 简单查看答案及解析
-
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流的作用下,氖原子与构成灯管的物质发生了化学反应
难度: 中等查看答案及解析
-
A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
①a-4 ②a-5 ③a+3 ④a+4
A. ①④ B. ②③ C. ①③ D. ②④
难度: 中等查看答案及解析
-
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为 。下列比较中正确的是( )
。下列比较中正确的是( )A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+离子的存在,说明共价键不应有饱和性
C. 所有共价键都有方向性
D. 两个原子轨道发生重叠后,两核间的电子不仅仅存在于两核之间,而是绕两个原子核运动
难度: 简单查看答案及解析
-
具有下列电子层结构的原子或离子,其对应的元素在周期表中的位置说法正确的
A. 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族
B. 3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族
C. 最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6的离子,所对应的两元素一定在同一周期
D. 原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、CCl4都是含有极性键的非极性分子
C. HF、HCl、HBr、HI的稳定性依次增强
D. CS2、H2O、C2H2都是直线形分子
难度: 中等查看答案及解析
-
下列关于配位化合物的叙述中,不正确的是( )
A. 配位化合物中必定存在配位键,可能存在极性键
B. 配位化合物中只有配位键
C. [Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键
D. 配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用
难度: 中等查看答案及解析
-
下列描述中正确的是( )
A. CS2为V形的极性分子 B. ClO3-的空间构型为平面三角形
C. SF6中有4对完全相同的成键电子对 D. SiF4和SO32-的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号
A
B
D
E
X
Y
Z
W
化合价
-1
-2
+4、-4
-1
+5、-3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
难度: 困难查看答案及解析
-
下列现象与氢键有关的是
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列分子中的中心原子杂化轨道的类型和分子构型都相同的是( )
A. CO2与SO2 B. NH3与SO3
C. CH4与NH4+ D. C2H2与C2H4
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和CH2O的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 直线形;平面三角形 D. V形;平面三角形
难度: 简单查看答案及解析
-
向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的AgNO3溶液,生成氯化银沉淀的物质的量为
A. 0mol B. 1mol
C. 2mol D. 3mol
难度: 简单查看答案及解析
-
某化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3°。下列推断不正确的是( )
A. AB2分子的空间构型为“V”形
B. A—B键为极性共价键,AB2分子为非极性分子
C. AB2与H2O相比,AB2的熔点、沸点比H2O的低
D. AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
难度: 困难查看答案及解析
-
某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像 ②利用手性催化剂合成可得到一种或主要得到一种手性分子 ③手性异构体分子组成相同 ④手性异构体性质相同 你认为正确的是( )
A. ①②③ B. ①②④ C. ②③④ D. 全部
难度: 简单查看答案及解析
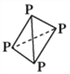 ,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。
,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。