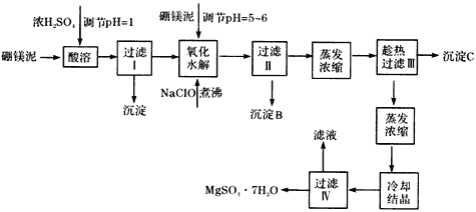
-
下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈
C. 加热氯化铁溶液颜色变深 D. 浓硫化钠溶液有臭味
难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥⑦⑧ D.②③⑤⑦⑧
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.甲烷的燃烧热是890kJ/mol,则甲烷燃烧的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
难度: 简单查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
难度: 简单查看答案及解析
-
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应: 2A(g)+B(g)
2C(g),若经2s(秒)后测得C的浓度为0.6mol·L-1现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L-1·S-1②用物质B表示的反应的平均速率为0.6mol·L-1·S-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
—定条件下,对于可逆反应X (g) +4Y (g)
2Z (g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),达到平衡时,X、Y、Z的浓度分別为0.lmol/L、0.4mol/L、 0.1mol/L,则下列判断正确的是( )
A. c1:c2=4:1 B. 平衡时,Y和Z的生成速率之比为1: 2
C. c1的取值范围为0mol/L<c1<0.14mol/L D. X、Y的转化率相等
难度: 中等查看答案及解析
-
下列措施或事实能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色逐渐变浅
B.H2、I2、HI平衡混合气缩小体积加压后颜色变深
C.工业上生产硫酸的过程中,SO2在催化氧化时条件控制为常压,而不是高压
D.工业上合成氨气时温度选择450℃左右,而不是常温
难度: 中等查看答案及解析
-
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
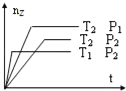
A. T1<T2,P1<P2 B. T1<T2,P1>P2 C. T1>T2,P1>P2 D. T1>T2,P1<P2
难度: 中等查看答案及解析
-
甲酸的下列性质中,可以证明它是弱电解质的是
A.甲酸以任意比与水互溶
B.0.1mol/L甲酸溶液的c(H+)=10-3mol/L
C.10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比一元强酸溶液的弱
难度: 简单查看答案及解析
-
某温度时,测得0.01 mol/L的NaOH溶液的pH为11,在此温度下,将pH=12的强碱与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比为( )
A. 1∶9 B. 9∶1 C. 1∶11 D. 11∶1
难度: 中等查看答案及解析
-
常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
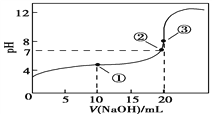
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
难度: 简单查看答案及解析
-
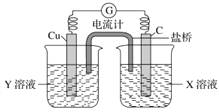
如图是课外活动小组设计的用化学电源使LED灯发光的装置。
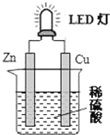
下列说法错误的是( )
A. 锌是负极,电子从锌片经导线流向铜片
B. 氢离子在铜片表面被还原
C. 如果将硫酸换成橙汁,导线中不会有电子流动
D. 装置中存在“化学能→电能→光能”的转换
难度: 中等查看答案及解析
-
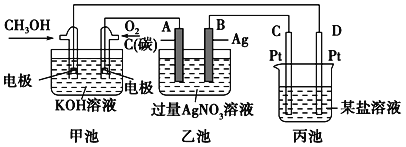
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
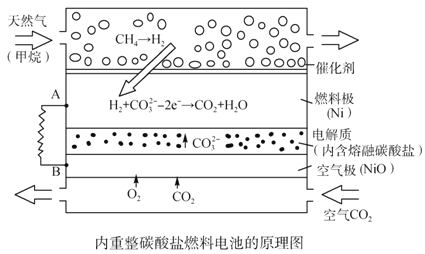
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
难度: 困难查看答案及解析
-
己知下表为25℃时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是
CH3COOH
HClO
H2CO3
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.4×10-7 Ka2=4.7×10-11
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
B. 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)=c(OH-)-c(H+)
C. 25℃时,0.10mol·L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)=c(CO32-)+ c (HCO3-)+c(H2CO3)
D. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中
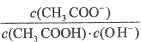 增大
增大难度: 困难查看答案及解析
-
下表是三种难溶金属硫化物的溶度积常数(25 ℃):下列有关说法中正确的是
化学式
FeS
CuS
MnS
溶度积
6.3×10-18
1.3×10-36
2.5×10-13
A. 25 ℃时,将CuS固体用含Mn2+的饱和溶液浸泡可溶解CuS固体
B. 25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol·L-1
C. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
D. 因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生
难度: 困难查看答案及解析