-
“低碳经济,节能减排”是21世纪世界经济发展的新思路。下列与之相悖的是( )
A.开发水能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料
B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
C.大力开采煤、石油和天然气,以满足经济发展的需要
D.大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放
难度: 中等查看答案及解析
-
A、B两原子,A原子L层比B原子M层少3个电子,B原子L层电子数恰为A原子L层电子数的2倍,则A、B分别是( )
A.硅和钠 B.硼和氮 C.碳和氯 D.碳和铝
难度: 中等查看答案及解析
-
下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )
A.10与19 B.6与16 C.11与17 D.14与8
难度: 中等查看答案及解析
-
下列各组物质中,化学键类型完全相同的是( )
A.HI和NaI B.H2S和CO2 C.H2O2和CCl4 D.Na2O2和NaBr
难度: 中等查看答案及解析
-
把太阳光变成激光可用于分解海水制氢气:2H2O
2H2↑+O2↑。下列说法正确的是( )
A.水的分解反应是放热反应 B.氢气是一次能源
C.使用氢气作燃料将会增加温室效应 D.在这一反应中,光能转化为化学能
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是( )
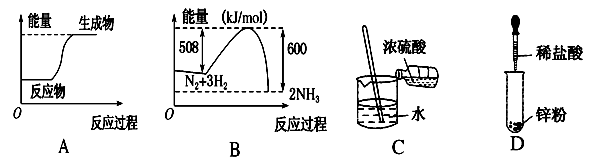
难度: 中等查看答案及解析
-
同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.原子半径:Z>Y>X
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的负化合价的绝对值按X、Y、Z顺序由大到小
难度: 中等查看答案及解析
-
下列各组中两种微粒所含电子数不相等的是( )
A.H3O+ 和OH- B.CO和N2 C.HNO2和NO D.CH 和NH
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.CO2 C.NH3 D.PCl5
难度: 中等查看答案及解析
-
某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是 ( )

难度: 困难查看答案及解析
-
我国的纳米基础研究能力已跻身于世界前列,如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,其化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的 ( )
A.第3周期第ⅤA族 B.第5周期第ⅢA族 C.第4周期第ⅢA族 D.第4周期第ⅤA族
难度: 中等查看答案及解析
-
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前 10号元素中,满足上述关系的元素共有 ( )
A. 1对 B.2对 C. 3对 D. 4对
难度: 中等查看答案及解析
-
最近科学家研制出一种新的分子,它具有类似白磷状结构,且分子中每个原子都满足8电子稳定结构,化学式为N4,下列说法正确的是( )
A.N4是一种新型化合物 B.N4和N2互为同素异形体
C.N4分子和N2一样含有N≡N D.N4中含极性共价键
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述,不正确的是( )
A.在金属区、非金属区交界线上,寻找具有半导体性能的材料
B.形成化合物种类最多的元素在第14列
C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族
D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n
难度: 中等查看答案及解析
-
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是
( )
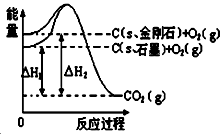
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJ•mol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
下列说法不正确的是( )
①质子数相同的粒子一定是同一种元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同的单质
⑤某元素的相对原子质量取整数值就是质量数
A.②④⑤ B.①④⑤ C.②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2bkJ/mol
B.C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=+2bkJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4bkJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+bkJ/mol
难度: 中等查看答案及解析
-
由于地球引力的存在,人在地球上生活而不能自动脱离地球。同理,原子之间能自动结合是因为它们之间存在着强烈的相互作用——化学键,由于有化学键才使得100多种元素构成了世界万物。下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键,可能含共价键,共价化合物中只含共价键绝不含有离子键
B.单质分子中均存在化学键,且只含有共价键,不可能含有离子键
C.共价化合物中可能含非极性共价键,离子化物中不可能含非极性共价键
D.共价化合物中可能含离子键,离子化合物中只含离子键
难度: 中等查看答案及解析
-
已知a An +, b B( n + 1 )+, c Cn–, d D( n + 1 )– 是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
A.原子半径:C>D>A>B B.原子序数:b>a>c>d
C.离子半径:C>D>A >B D.单质还原性:A>B>C>D
难度: 中等查看答案及解析
-
关于下列粒子的描述不正确的是( )
A.PH3的电子式为
,其热稳定性不如NH3
B.HS-的电子式为
,是含有极性键的18电子的粒子
C.CH2Cl2的电子式为
,是结构呈正四面体的分子
D.KF的电子式为
,它是易溶于水的离子化合物
难度: 中等查看答案及解析