-
下列涉及有机物的说法正确的是:
A.乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.丙烷是一种清洁燃料,可用作燃料电池的燃料
C.苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴
D.淀粉和纤维素水解产物都是葡萄糖,因此二者互为同分异构体
难度: 困难查看答案及解析
-
分别取PH均等于2的盐酸和醋酸各l00mL,稀释2倍后,再分别加入0.325g锌粉,在相同条件下充分反应,下列有关叙述正确的是
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.反应开始时,盐酸与锌反应的速率大
D.反应开始时,盐酸和醋酸分别与锌反应的速率一样大
难度: 困难查看答案及解析
-
下列各项实验操作中,正确的是
A.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
B.为加快过滤速度,可用玻璃棒搅拌过滤器中的食盐水
C.为迅速除去乙酸乙酯中的少量乙酸,可加入足量NaOH溶液并加热
D.为使制取H2的速率加快,可向稀H2SO4中加少量CuSO4溶液
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
B.次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+ 2HClO
C.向100mL1mol/L的FeBr2溶液中通入 0.15mol Cl2 :
2Fe2++4Br-+3Cl2= 2Fe3++2Br2+6Cl-
D.向明矾溶液逐滴加入Ba(OH)2溶液至Al3+离子刚好沉淀完全
Al3++SO42-+Ba2++3OH-=BaSO4↓ +Al(OH)3↓
难度: 困难查看答案及解析
-
当燃烧8.96升由CH4 、CO、C2H6 组成的混和气体时,除生成水外,还生成13.44升CO2气体(气体体积均在标准状况下测定).则原混和气体中含C2H6的物质的量是
A.0.8 mol B.0.6 mol C.0.4 mol D.0.2 mol
难度: 困难查看答案及解析
-
下列说法正确的是:
A.硼元素(相对原子质量为10.8)只有两种同位素10B与11B,则其原子质量比为1:4
B.共价化合物中可能有离子键,离子化合物中可能有共价键
C.和原子序数为x的第ⅡA族元素同周期的第ⅢA族元素的原子序数可能是x+1或x+11或x+25
D.原子序数小于11的两种元素原子的核外电子层数之比与最外层电子数之比相等的元素共有3对
难度: 困难查看答案及解析
-
在200mL含Mg2+、Al3+、、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
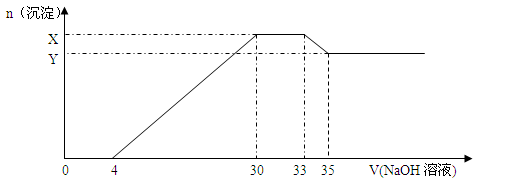
下列叙述正确的是
A. x与y的差值为0.02mol B.原溶液中c(Cl-)=0.825mol/L
C. 原溶液的PH=2 D原溶液中n(Mg2+):n(Al3+)=5:2
难度: 困难查看答案及解析