-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含单键数目为0.7NA
C.标准状况下.5.6 LCO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL1 2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 简单查看答案及解析
-
下列相关反应的离子方程式书写错误的是
A.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO﹣+4OH﹣+2Fe(OH)3=3Cl﹣+5H2O+2FeO42﹣
B.少量SO2通入苯酚钠溶液中:2C6H5O﹣+SO2+H2O=2C6H5OH+SO32﹣
C.用稀硫酸酸化的KMnO4溶液与H2O2反应:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O
D.SO2通入NaClO溶液中:SO2+ClO﹣+OH﹣=SO42﹣+Cl﹣+H+
难度: 中等查看答案及解析
-
T℃时气体A与气体B在某容器中反应生成气体C,反应过程中A、B、C浓度变化如图①所示.若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图②所示.
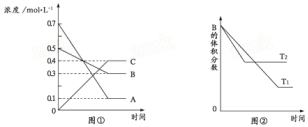
则下列结论正确的是
A.该反应的化学方程式是A+3B═2C
B.该反应的正反应为放热反应
C.定容条件下,混合气体的密度不再变化,则证明该反应达到平衡
D.压强增大,则该反应的正反应速率增大,逆反应速率减小
难度: 简单查看答案及解析
-
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(如图甲)在煤矿巷道中的甲烷浓度达到一定值时,其传感器就可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是
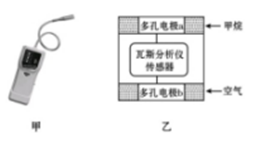
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2--8e-
CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
难度: 简单查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是

A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.d点溶液中含有的溶质只有Na2SO4
难度: 困难查看答案及解析
-
工业上,可用硫酸铈[Ce(SO4)2]溶液吸收尾气中NO,其化学方程式如下:2NO+3H2O+4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4 ,下列说法正确的是
A.在该反应中氧化剂与还原剂的物质的量之比为1∶2
B.在该反应中,氧化产物有两种,还原产物有一种
C.若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大
D.在该反应中,每消耗22.4LNO必转移2 mol电子
难度: 中等查看答案及解析
-
往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)
A.
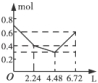 B.
B.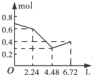 C.
C. D.
D.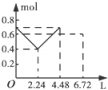
难度: 中等查看答案及解析