-
短周期元素X、Y、Z所在的周期序数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同.下列化合物中同时存在极性和非极性共价键的是( )
A.Z2Y
B.X2Y2
C.Z2Y2
D.ZYX难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.2 mol H2O2完全分解转移的电子数为0.4 NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA难度: 中等查看答案及解析
-
下列有关描述正确的是( )
A.主族元素A、B、C、D的离子aA2+、bB+、cC2ˉ、dDˉ(n为正整数)具有相同的电子层结构,则原子序数大小关系为a>b>c>d
B.非金属元素的原子半径越小越容易得电子,该元素最高价氧化物的水化物酸性一定也越强
C.随原子序数的增大,碱金属元素单质的密度逐渐增大,ⅦA元素的单质的熔沸点逐渐升高
D.两种同位素137Cs和133Cs形成的单质化学性质几乎完全相同难度: 中等查看答案及解析
-
现有①NaOH ②Al2(SO4)3 ③Ba(NO3)2④CuSO4⑤FeCl3 ⑥淀粉溶液 ⑦KI 这7种溶液( )
A.不需外加试剂即可鉴别
B.必须外加试剂才能鉴别
C.如有碘水即能全部鉴别
D.另有一种溶液即可鉴别难度: 中等查看答案及解析
-
下列实验操作完全正确的是( )
编号 实验 操作 A 证明SO2有漂白性 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 B 配制1000mL一定物质的量浓度的硫酸溶液 准确称取一定体积浓硫酸,放入到1000mL的容量瓶中,加水稀释,振荡摇匀定容 C 除去FeCl3溶液中混有的FeCl2 向溶液中通入过量氯水,然后加热煮沸就得到了纯净的FeCl3溶液 D 检验Br-的存在 在溶液中先加入氯水、在加入CCl4.振荡、静置,观察下层溶液显橙红色
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
金属冶炼技术随人类对自然界认识的不断深入而发展.下列金属中,常用作还原剂冶炼其他金属的是( )
A.Hg
B.Ag
C.Cu
D.Al难度: 中等查看答案及解析
-
下列关于化学键和化合物的说法中正确的是( )
A.化学键的形成一定伴随着电子的得失
B.金属元素和非金属元素形成的化合物一定是离子化合物
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子难度: 中等查看答案及解析
-
下面均是正丁烷与氧气反应的热化学方程式(25℃、101kPa):
①C4H10(g)+O2(g)═4CO2(g)+5H2O(l);△H=-2 878kJ•mol-1
②C4H10(g)+O2(g)═4CO2(g)+5H2O(g);△H=-2 658kJ•mol-1
③C4H10(g)+O2(g)═4CO(g)+5H2O(l);△H=-1 746kJ•mol-1
④C4H10(g)+O2(g)═4CO(g)+5H2O(g);△H=-1 526kJ•mol-1
由此判断,正丁烷的燃烧热为( )
A.-2878 kJ/mol
B.-2 658kJ/mol
C.-1746 kJ/mol
D.-1526 kJ/mol难度: 中等查看答案及解析
-
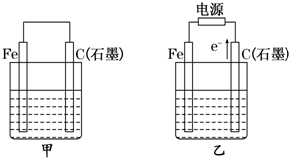
科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料.电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.下列对该燃料电池的说法不正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2=3CO2+4H2O
C.电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O难度: 中等查看答案及解析
-
核内中子数为N的R2+离子,质量数为A,则n g 它的氧化物中所含质子的物质的量为( )
A.
B.
C.(A-N+2)mol
D.难度: 中等查看答案及解析
-
短周期元素X、Y可以形成化合物XY2,下列有关叙述正确的是( )
A.若XY2是共价化合物,则X与Y的原子序数不可能相差1
B.若XY2是离子化合物,则X与Y的原子序数可能相差8
C.若X与Y的原子序数相差5,则离子化合物XY2不溶于水
D.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至SO42-沉淀完全;2H++SO42-+Ba2++2OH-═BaSO4↓+2 H2O
B.碳酸钠与醋酸溶液反应:CO32-+2 H+═CO2+H2O
C.氢氧化亚铁与硝酸溶液混合:Fe(OH)2+2 H+═Fe2++2 H2O
D.在Ba(OH)2溶液中滴加少量NaHCO3溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O难度: 中等查看答案及解析
-
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种.
①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③向淀粉溶液中滴加橙黄色溶液未变蓝色.
根据上述实验事实推断,在该溶液中肯定存在的离子组是( )
A.Na+、Br-、CO32-
B.Na+、I-、SO32-
C.Fe2+、I-、SO32-
D.Fe2+、Br-、CO32-难度: 中等查看答案及解析
-
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.
B.(2b-a)mol/L
C.
D.(10b-5a)mol/L难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键难度: 中等查看答案及解析
-
已知:Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是( )
A.-824.4kJ•mol-
B.-627.6kJ•mol-1
C.-744.7kJ•mol-1
D.-169.4kJ•mol-1难度: 中等查看答案及解析
-
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积(单位mL)变化的关系如下图A所示.下列说法中不正确的是( )
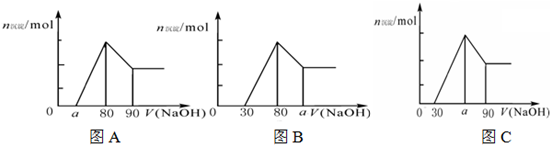
A.a的取值范围为0≤a<50
B.的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90难度: 中等查看答案及解析