-
化
学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
用热的纯碱溶液洗去油污
Na2CO3可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3
C
用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂
酸性高锰酸钾溶液能还原水果释放的催熟剂乙烯
D
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
难度: 困难查看答案及解析
-
下列有关仪器的使用方法、实验操作或实验结果正确的是
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准液前,不需用该标准溶液润洗
C.锥形瓶用作反应容器时一定不能加热
D.蒸馏时若温度计水银球的位置低于蒸馏烧瓶支管口,可能会导致产品中混有低沸点杂质
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A.18gD2O和18gH2O中含有的质子数均为10NA
B.1L0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.室温下,l L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.l NA
难度: 中等查看答案及解析
-
下列物质分类正确的是
① 混合物:铝热剂、福尔马林、水玻璃、漂白粉 ② 化合物:CaCl2、烧碱、聚乙烯、HD
③ 电解质:明矾、绿矾、冰醋酸、硫酸钡 ④ 同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤ 同素异形体:C60、C70、金刚石、石墨
A. ①②④ B.②③④ C. ①③⑤ D .②④⑤
难度: 简单查看答案及解析
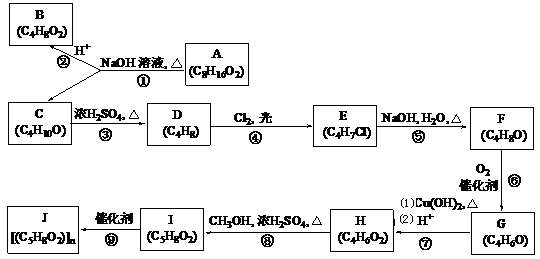
-
分子式为C5H10O2的有机物A,有果香味,不能使紫色石蕊试液变红,但可在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有
A.1种 B.6种 C.8种 D.18种
难度: 简单查看答案及解析
-
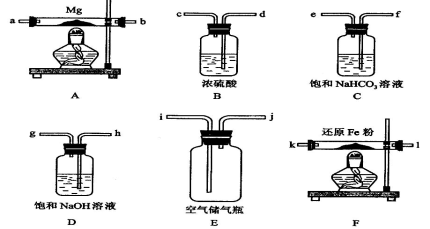
用图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是
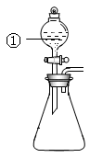
选项
①中物质
锥形瓶中物质
预测锥形瓶中的现象
A.
浓盐酸
“84”消毒液
有黄绿色气体产生
B.
浓硝酸
光洁的铁钉
产生红棕色气体
C.
氯化铝溶液
浓氢氧化钠溶液
先有白色沉淀生成,后沉淀又溶解
D.
草酸溶液
酸性高锰酸钾溶液
溶液逐渐褪色,
有黑色沉淀生成
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH-
===2 Al(OH)3↓+3BaSO4↓
C.氯化钠与浓硫酸混合加热:H2SO4+2Cl-===SO2↑+Cl2↑+H2O
D.向AgCl悬浊液中滴加Na2S溶液;白色沉淀变成黑色2AgCl+S2-===Ag2S↓+2C
l-
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6
C.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
D.根据HCl的酸性远强于H2S,可推出结合质子能力:S2-<Cl-
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。
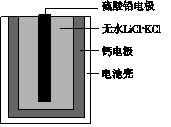
该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是
A.常温时,在正负极间接上电流表或检流计,指针不偏转
B.放电过程中,Li+向负极移动
C.每转移0.2mol电子,理论上生成41.4g Pb
D.正极反应式:Ca+2Cl--2e-===CaCl2
难度: 简单查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
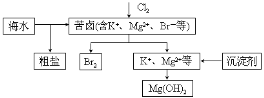
A.向苦卤中通入Cl2前,可先用稀硫酸酸化
B.工业生产中常选用KOH作为沉淀剂
C.粗盐可采用除杂和重结晶等过程提纯
D.富集溴可用热空气吹出单质溴,原因是溴单质沸点低,易挥发
难度: 简单查看答案及解析
-
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是
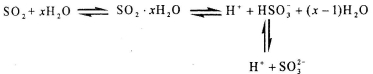
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸都能放出SO2气体
D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液
难度: 困难查看答案及解析
-
氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移6mol电子
C.AlN属于离子化合物,其中氮元素的化合价为+3
D.AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
难度: 中等查看答案及解析
-
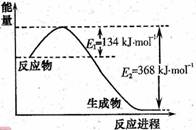
25 ℃、101 kPa下:①2Na(s)+
1/2O2(g)===Na2O(s) ΔH1=-414 kJ/mol
②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ/mol
下列说法正确的是
A.①和②生成等物质的量的产物,阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ/mol
难度: 中等查看答案及解析
-
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时n(CO2)=0.30 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800 ℃,
上述反应平衡常数为0.64,则正反应为吸热反应
难度: 中等查看答案及解析