-
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1
据此判断,下列说法中正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高难度: 中等查看答案及解析
-
带核的原子结构模型是下列哪位科学家提出的 ( )
A.道尔顿
B.阿伏加德罗
C.玻尔
D.卢瑟福难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.锌与硫酸铜溶液反应
B.灼热的木炭与H2O的反应
C.Ca(OH)2与NH4HCO3的反应
D.固体NH4NO3溶入水中难度: 中等查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性难度: 中等查看答案及解析
-
下列各组粒子中属于同位素的是( )
A.H2和D2
B.H2O和D2O
C.16O和18O
D.24Mg和24Na难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.加热
B.不用铁片,改用铁粉
C.滴加少量CuSO4溶液
D.不用稀硫酸,改用98%的浓硫酸难度: 中等查看答案及解析
-
下列现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁心(几乎是纯铁)容易生锈
C.铁制器件附有铜质配件,在接触处易生锈
D.银质奖牌在空气中久置后表面变暗难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2.由此可知,该电池充电时的阳极是( )
A.Cd(OH)2
B.Ni(OH)2
C.Cd
D.NiO(OH)难度: 中等查看答案及解析
-
二次世界大战时,科学家玻尔为避免诺贝尔奖章落入德军手中,将金质奖章溶解在“王水”中,其化学方程式:Au+HNO3+4HCl=HAuCl4+x↑+2H2O,则x的化学式为( )
A.NO
B.NO2
C.N2O
D.NH3难度: 中等查看答案及解析
-
-NMR(核磁共振)可用于含碳化合物的结构分析,
表示的是( )
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数是13,原子序数是6,核内有7个质子
D.质量数是13,原子序数是6,核内有7个中子难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法正确的是( )
A.0.5mol Al 与足量盐酸反应失去电子数为NA
B.0.2mol H2O所含的H原子数为0.2NA
C.0.1mol NH3所含的电子数为NA
D.46g NO2和N2O4的混合物含有的分子数为NA难度: 中等查看答案及解析
-
下列物质中,只含有离子键,不含有共价键的是( )
A.HCl
B.KOH
C.CaCl2
D.CO2难度: 中等查看答案及解析
-
在一定温度下,密闭容器中可逆反应H2(g)+I2(g)⇌2HI(g)达到平衡的标志是( )
A.单位时间内生成1 mol H2,同时生成1 mol 的HI
B.容器内总压强不随时间而变化
C.一个H-H键断裂的同时有一个I-I键形成
D.容器内物质H2、I2、HI的分子个数比为1:1:2难度: 中等查看答案及解析
-
下列不属于生物质能利用方式的是( )
A.燃烧植物的秸秆和枝叶以获取热能
B.利用人畜粪便等物质在发酵池中,经过沼气细菌的作用,生成沼气
C.利用植物的光合作用生成葡萄糖,进而生成淀粉、纤维素
D.在汽化炉内加热固态生物质,同时加入空气,使之发生反应生成可燃气体难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层8电子结构的是( )
A.乙炔
B.三氟化硼
C.五氯化磷
D.二硫化碳难度: 中等查看答案及解析
-
国外新近研制的溴化锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液. 现有四个电极反应:①Zn-2e=Zn2+ ②Zn2++2e=Zn ③Br2+2e=2Br- ④2Br--2e=Br2.那么,充电时的阳极和放电时的负极反应分别是( )
A.④①
B.②③
C.③①
D.②④难度: 中等查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
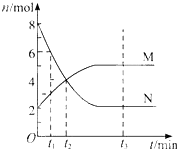
A.反应的化学方程式为:2M⇌N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍难度: 中等查看答案及解析
-
如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
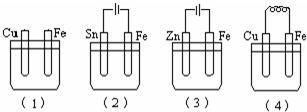
A.(4)(3)(2)(1)
B.(4)(3)(1)(2)
C.(3)(4)(1)(2)
D.(4)(3)(1)(2)难度: 中等查看答案及解析
-
下列性质的比较中,正确的是( )
A.沸点:NH3<PH3<AsH3<SbH3
B.微粒半径:Al3+<Na+<K+<S2-
C.热稳定性:CH4>PH3>H2O>HF
D.酸性:H2SO4>H3PO4>HNO3>H2CO3难度: 中等查看答案及解析
-
氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+O2(g)=H2O(l)△H=-285.8kJ/mol
CO(g)+O2(g)=CO2(g)△H=-282.6kJ/mol
C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5472kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-889.6kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2(g)
B.CO(g)
C.C8H18(l)
D.CH4(g)难度: 中等查看答案及解析
-
电解溶质质量分数为26.0%的饱和食盐水100g,通入0.200mol电子后溶液中NaOH的质量分数的理论值是( )
A.8.02%
B.8.00%
C.8.63%
D.8.61%难度: 中等查看答案及解析