-
下列关于能源和作为能源的物质叙述错误的是 ( )
A. 化石能源物质内部蕴涵着大量的能量
B. 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C. 物质的化学能可以在不同的条件下转化为热能、电能被人类利用
D. 吸热反应没有利用价值
难度: 简单查看答案及解析
-
下列各图所反映的措施中,目的是为了加快其化学反应速率的是
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
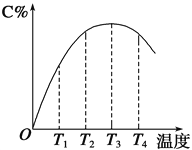
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时, 按正反应速率由大到小的顺序排列,正确的是
①500 ℃, 10 mol SO2和5 mol O2反应
②500 ℃, 用V2O5作催化剂, 10 mol SO2和5 mol O2反应
③450 ℃, 8 mol SO2和5 mol O2反应
④500 ℃, 8 mol SO2和5 mol O2反应。
A. ②①④③ B. ②①③④ C. ①②③④ D. ④③②①
难度: 中等查看答案及解析
-
某温度下反应N2O4(g)
2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
①加压时(体积变小),将使正反应速率增大②保持体积不变,加入少许NO2,将使正反应速率减小;③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;④保持体积不变,升高温度,再达平衡时颜色变深 ⑤升高温度,正反应速率减小,平衡逆向移动
A. ①④⑤ B. ③④⑤ C. ①③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
对于反应CH2=CH2+H2 → CH3CH3,反应过程的能量变化如图所示。下列说法正确的是
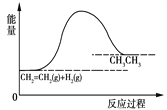
A. 此反应不属于氧化还原反应
B. 此反应的ΔH<0
C. 此反应中反应物的能量总和大于产物的能量总和
D. 1分子乙烯和1分子氢气的键能总和大于1分子乙烷的键能总和
难度: 简单查看答案及解析
-
下列反应是工业生产硝酸的一个反应过程,4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-1025 kJ/mol,若反应物起始的物质的量相同。下列关于该反应的示意图不正确的是
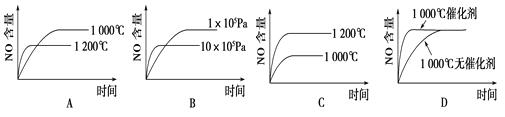
难度: 简单查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2H2O2
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C. 反应CO+NO2
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D. 合成氨反应:N2+3H2
2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
难度: 中等查看答案及解析
-
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
A. 把铁块换成铁粉 B. 将容器的体积压缩至原体积的一半
C. 压强不变,充入氮气使容器体积增大 D. 体积不变,充入氮气使容器压强增大
难度: 中等查看答案及解析
-
下列实验事实与相应结论不正确的是
选项
实验事实
结论
A
其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短
当其他条件不变时,增大反应物浓度可以使化学反应速率加快
B
其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊
当其他条件不变时,反应体系的温度越高,化学反应速率越快
C
将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变
催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程
D
一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)
2HI(g),获得等量HI时需要的时间前者少
当其他条件不变时,气态反应体系的压强越大,化学反应速率越快
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
反应mA(固)+nB(气)
pC(气)△H<O在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是
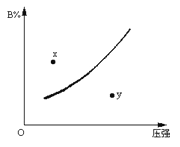
①m+n>P;②x点表示该反应的正反应速率大于逆反应速率;
③n>p;④x点比y点时的反应速率慢。
A. 只有① B. 只有②④ C. 只有①②④ D. 只有①和③
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知C(石墨, s)=C(金刚石, s); ΔH>0 则石墨比金刚石稳定
D. 1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1
难度: 简单查看答案及解析
-
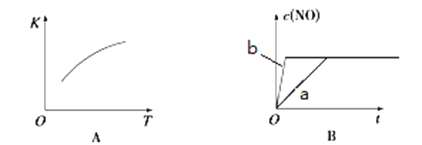
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
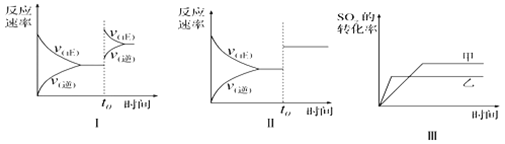
A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻增大压强后对反应速率的影响
C. 图III研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影晌.且乙的温度较高
难度: 中等查看答案及解析
-
100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2 (g),下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A. ②③⑥⑦ B. ①④⑧ C. 只有①④ D. 只有⑦⑧
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1mol酸与1mol碱完全反应放出的热量就是中和热
B. 燃烧热随化学方程式的化学计量数的改变而改变
C. 强酸强碱中和热的热化学方程式可表示为:H+(aq)+OHˉ(aq)═H2O(l)△H=57.3 kJ/mol
D. 反应物总能量大于生成物总能量,则反应的△H<0
难度: 中等查看答案及解析
-
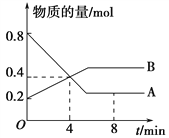
向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g)
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)
2Z(g) ΔH <0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/ mol
0.12
0.11
0.10
0.10
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 该温度下此反应的平衡常数:K=1.44
D. 保持其他条件不变,升高温度该反应的平衡常数将增大
难度: 中等查看答案及解析
-
有一化学平衡:mA(g)+nB(g)
pC(g)+qD(g),如图是表示A的转化率与压强、温度的关系,分析下图可以得出的正确结论是
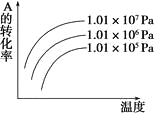
A. 正反应是吸热反应,且m+n>p+q
B. 正反应是吸热反应,且m+n<p+q
C. 正反应是放热反应,且m+n>p+q
D. 正反应是放热反应,且m+n<p+q
难度: 中等查看答案及解析
-
反应A(g)+B(g)
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
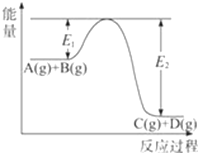
(1)该反应是_________(填“吸热”“放热”)反应。
(2)反应达到平衡时,升高温度,A的转化率____(填“增大”“减小”或“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1____________________E2-E1__________________(填“增大”“减小”或“不变”)。
(4)在火箭推进器中装有肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量的气体,并放出大量热。己知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。写出该反应的热化学方程式____________________________________。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
难度: 中等查看答案及解析