-
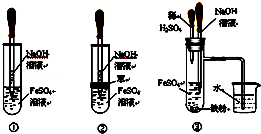
下列物质的包装上贴错了危险警告标签的是( )

难度: 简单查看答案及解析
-
环境问题越来越受到人们的关注,下列有关叙述不正确的是( )
A.空气质量监测中的PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称可入肺颗粒物
B.采用纳米TiO2光触媒技术,将汽车尾气中的NO和CO转化为无害气体
C.大量排放SO2或CO2都会导致酸雨的形成
D.利用太阳能、潮汐能、风力发电,以获取清洁能源减少污染
难度: 简单查看答案及解析
-
日本大地震造成了福岛第一核电站核放射性物质
I和
Cs向外界泄漏.下列相关说法错误的是( )
A.CsOH的碱性比KOH强 B.
Cs中有82个中子
C.HI比HF还原性强 D.KIO3是碘的最高价含氧酸盐
难度: 中等查看答案及解析
-
以下物质间的转化不能通过一步反应实现的是( )
A.HCl→Cl2 B.NH3→NO C.S→SO2 D.SiO2→H2SiO3
难度: 中等查看答案及解析
-
Mg、SO2、2SO4、aOH、aCl的顺序是按某一分类规律排列的.下列物质的排序符合此分类规律的是( )
A.Na2CO3、C、CO2、Ca(OH)2、HNO3
B.Na3PO4、Na、SO2、H2SO3、KOH
C.Si、CO2、H3PO4、Ba(OH)2、Na2S
D.N2、NO、HNO3、NH3、NaBr
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L CCl4中共价键数目为4NA
B.22.4 L O2和N2的混合气体中一定含有的原子数为2NA
C.常温常压下,6 g NO2和40 g N2O4混合气体中的原子总数为3NA
D.25℃时,1mol•L﹣1醋酸溶液中所含CH3COOH分子总数一定小于NA
难度: 困难查看答案及解析
-
下列离子在溶液中能大量共存的是( )
A.Fe3+ NH4+ SCN﹣ Cl﹣ B.Fe3+ Fe2+ Na+ NO3﹣
C.Ba2+ H+ NO3﹣ SO42﹣ D.S2﹣ Na+ ClO﹣ OH﹣
难度: 中等查看答案及解析
-
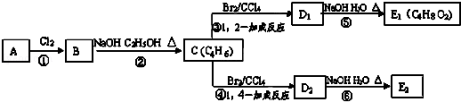
根据表中有机物分子式的排列规律确定空格中有机物的同分异构体数目是( )
1
2
3
4
5
6
CH4O
C2H4O2
C4H8O2
C5H12O
C6H12O2
A.2 B.3 C.4 D.5
难度: 困难查看答案及解析
-
丙烯醇(CH2=CH﹣CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③置换 ④加聚 ⑤取代.
A.只有①②③ B.只有①②③④ C.①②③④⑤ D.只有①③④
难度: 中等查看答案及解析
-
下列说法不正确的是①将盛有二氧化氮气体的试管倒立在水中,溶液充满试管 ②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成了一层致密的氧化膜 ③向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性( )
A.①② B.②③ C.①③ D.①②③
难度: 中等查看答案及解析
-
下列关于实验的叙述正确的是( )
A.向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.乙烯能被高锰酸钾氧化,利用此反应可鉴别乙烷和乙烯
C.实验室通常用加热分解NH4Cl固体的方法制取氨气
D.直接观察某盐溶液的焰色反应为黄色,则该溶液中一定不含钾元素
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.常温下pH=1的盐酸与pH=13的Ba(OH)2溶液中水的电离程度相等
B.物质的量浓度均为0.1mol•L﹣1的H2SO4和NaOH溶液等体积混合后pH>7
C.分别将pH=3的盐酸、醋酸稀释100倍后,pH都为5
D.pH=14与pH=12的两种NaOH溶液等体积混和后,c(H+)=
(10﹣14+10﹣12)
难度: 困难查看答案及解析
-
硫酸厂产生的尾气中含有SO2污染环境,可用来测定SO2含量的试剂是( )
A.品红溶液 B.浓硝酸
C.碘水、淀粉溶液 D.以上都能
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.焓变和熵变都与反应的自发性有关,又都不能独立作为自发性的判据
B.﹣10℃时的液态水会自动结冰成为固态,这是熵增的过程
C.过程的自发性既可用于判断过程的方向,也可确定过程是否能发生和过程发生的速率
D.△H>0的反应一定不能自发进行
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Na2CO3水【解析】
CO32﹣+2H2O⇌H2CO3+2OH﹣B.用惰性电极电解饱和NaCl溶液:2Cl﹣+2H2O
Cl2↑+H2↑+2OH﹣
C.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl﹣
D.等体积等物质的量浓度的Ca(HCO3)2与NaOH溶液反应:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣
难度: 困难查看答案及解析
-
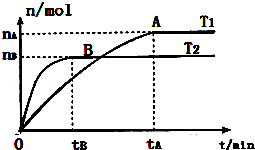
向Na2SO4和Al2(SO4)3的混合溶液中,逐滴加入KOH溶液.下列图象能正确表示反应生成沉淀的质量(m)与加入KOH溶液体积(v)的关系是( )
A.
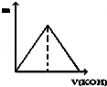 B.
B.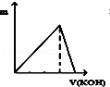 C.
C.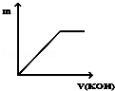 D.
D.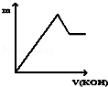
难度: 困难查看答案及解析
-
下列实验装置叙述正确的是( )

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的SO2
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2或CO2气体.
A.①③⑤ B.③⑤ C.①②④ D.③④
难度: 中等查看答案及解析
-
把铝粉和氧化铁粉配成铝热剂,分成两等份.一份在高温下恰好完全反应后,再与足量盐酸起反应;另一份放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体的质量比是( )
A.1:1 B.2:3 C.3:2 D.28:9
难度: 困难查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
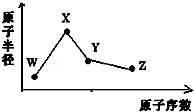
下列判断正确的是( )
①W在元素周期表位置是二周期ⅦA族
②Y的氢化物是正四面体结构
③X的氢化物可以用来腐蚀玻璃
④Z的最高价氧化物对应的水化物酸性比Y的强
⑤Y单质的另一重要用途是做光导纤维
⑥W、X、Y形成的化合物是制备木材防火剂的原料.
A.②④⑥ B.③④⑤⑥ C.②③④⑤ D.①②④
难度: 困难查看答案及解析
-
能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
A.用Cu作阴、阳电极,电解CuCl2溶液
B.用Cu作阴、阳电极,电解K2SO4溶液
C.铜锌合金在潮湿空气中发生电化学腐蚀
D.Cu作原电池的负极,碳棒作正极,NaCl溶液作电解质溶液
难度: 中等查看答案及解析
-
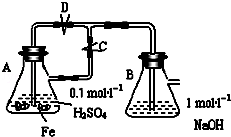
研究人员发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反
应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl 下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式Ag+Cl﹣﹣e﹣═AgCl
B.AgCl是还原产物
C.Na+不断向“水”电池的负极移动
D.每生成1 mol Na2Mn5O10转移2 mol电子
难度: 困难查看答案及解析
-
下列溶液中粒子浓度的关系正确的是( )
A.0.1 mol•L﹣1 Na2CO3溶液中:2c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
B.0.1 mol•L﹣1 CH3COONa溶液中:c(OH﹣)=c(H+)+c(CH3COOH)
C.pH相同的①CH3COONa②NaHCO3两份溶液中的c(Na+):①<②
D.用NaOH溶液滴定CH3COOH溶液至pH=7时:c(Na+)>c(CH3COO﹣)>c(OH﹣)=c(H+)
难度: 困难查看答案及解析