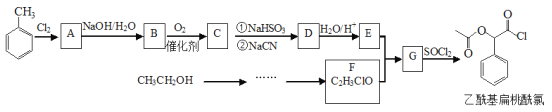
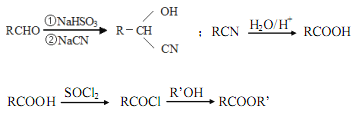
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。下列实验操作、现象和解释或结论不正确的有
序号
实验操作
实验现象
解释或结论
①
用大理石和稀硝酸反应制取CO2气体,将制得的气体立即通入一定浓度的Na2SiO3溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
②
向某溶液中加入浓NaOH溶液后微热,用蓝色石蕊试纸检验产生的气体
放出刺激性气味气体且试纸变红
原溶液中一定含有NH4+
③
少量铝热剂(只有一种金属氧化物)溶于足量稀盐酸后,分两份,再分别滴加铁氰化钾和KSCN溶液
出现蓝色沉淀和血红色
铝热剂中可能含有Fe3O4
④
向某钾盐中滴加浓盐酸,产生的气体再通入品红溶液
品红溶液褪色
该钾盐为K2SO3与KHSO3至少有一种
⑤
用pH试纸测量饱和新制氯水的pH
pH试纸先变为红色后褪色
饱和新制氯水呈酸性且Cl2具有漂白性
A. ①②④⑤ B. ②③④⑤ C. ①②④ D. ①②③⑤
难度: 困难查看答案及解析
-
下列说法正确的是
A. 分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加2滴酚酞溶液,后者红色更深
B. 分别向2 mL5%H2O2溶液中滴加1 mL 0.1 mol·L−1 FeCl3和CuSO4溶液,产生气泡快慢不相同
C. 蛋白质溶液遇饱和Na2SO4溶液或醋酸铅溶液均产生沉淀,沉淀均可溶于水
D. 加热NH4Cl和Ca(OH)2固体的混合物,可将二者分离
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法正确的是( )
A. 全球首段光伏高速公路亮相济南,光伏发电所用电池板主要材料是二氧化硅
B. 《物理小识》记载“青矾(绿矾) 厂气熏人,衣服当之易烂,栽木不茂”,青矾厂气是CO和CO2
C. 平昌冬奥会“北京8分钟” 主创团队用石墨烯制作发热服饰,说明石墨烯是能导热的金属材料
D. 《本草纲目》描述“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”其中的碱是K2CO3
难度: 简单查看答案及解析
-
反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g)△H>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是( )
A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则△S<0
D. 反应中生成1molNaH2PO2,转移电子数目为3×6.02×1023
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g
B. 1mol乙酸与足量的C2H518OH 充分发生酯化反应可生成CH3CO18OC2H5分子NA个
C. 9g13CO2与N217O的混合物中所含中子数为4.6NA
D. 浓度均为lmol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH 和CH3COO-的总数为2NA
难度: 中等查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是
A. 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B. 蛋白质和油脂都属于高分子化合物,一定条件下能水解
C. 甲烷和氯气反应生成一氯甲烷,苯和硝酸反应生成硝基苯的反应类型相同
D. 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 中等查看答案及解析
-
下列说法正确的一组是
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物
A.①③⑤⑥ B.②④⑤⑥
C.只有⑤ D.只有⑥
难度: 困难查看答案及解析
-
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )
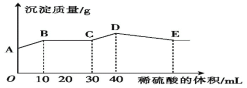
A.AB段发生反应的离子方程式为Ba2++SO42-=BaSO4↓
B.BC段发生反应的离子方程式为H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3
D.E点时溶液中含有大量的AlO2-
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A. 向Na2S2O3溶液中通入足量氯气:S2O32-+ 2Cl2+3H2O=2SO32-+4Cl-+6H+
B. 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O
D. 等体积、等浓度的Ba(OH)2稀溶液与NaHSO4稀溶液混合:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
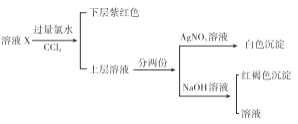
A. 溶液X中有Fe3+、SO42﹣
B. 溶液X中有Fe2+、I﹣可能有SO42﹣、Cl﹣
C. 溶液X中有I﹣、Cl﹣,无CO32﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
难度: 困难查看答案及解析
-
短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径: Y>Z>R>X
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B. 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C. 向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D. 将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
难度: 中等查看答案及解析
-
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
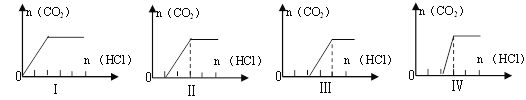
则下列分析都正确的组合是 ( )
溶质的成分
对应图象
溶液中离子浓度关系
A
NaHCO3、Na2CO3
Ⅱ
c(CO32-)<c(HCO3-)
B
NaOH、Na2CO3
Ⅲ
c(OH-)>c(CO32-)
C
Na2CO3
Ⅳ
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D
NaHCO3
I
c(Na+)=c(HCO3-)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
①pH = 0的溶液:Na+、C2O42—、MnO4—、SO42—
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-
A.①②⑤ B.①③⑥ C.②④ D.①②④
难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A. 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
D. 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
难度: 困难查看答案及解析
-
已知K2Cr2O7溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O
2H++ 2CrO42- (黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42- + 4H2O
下列分析正确的是
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
难度: 困难查看答案及解析
-
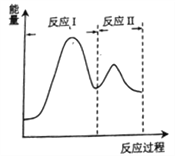
下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 向纯碱溶液中滴加醋酸,将生成的气体通入澄清的苯酚钠溶液中,观察是否出现沉淀,由此证明醋酸、碳酸、苯酚酸性强弱
C. 反应A(g)
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
难度: 困难查看答案及解析
-
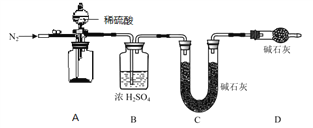
实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是

A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
难度: 中等查看答案及解析
-
一定量的铁、镁和铜的混合物与一定量的浓HNO3恰好反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入2mol/L的NaOH溶液至Fe3+、Mg2+、Cu2+恰好沉淀,则消耗NaOH 溶液的体积是( )
A. 400 mL B. 200 mL C. 150 mL D. 80 mL
难度: 简单查看答案及解析