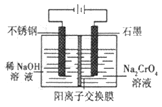
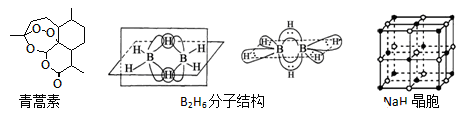
-
2017年元旦期间,全国大部分地区迎来“新年霾”。下列做法与“雾霾”的防护与治理相违背的是
A. 开发利用清洁能源 B. 工厂使用低硫煤
C. 增加植被面积 D. 大力提倡燃煤供暖
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1.0L1.0mol·L-1的NaAlO2溶液中含有的氧原子数为2NA
B. 2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C. 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15 NA
D. 用生氢剂CaH2与水反应制氢时,生成1molH2时转移电子数目为2 NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.
的系统命名为:2-甲基-2-乙基丙烷
B. 在碱性条件下,CH3CO18OC2H5水解产物是CH3COOH和C2H518OH
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 以丙烯为单体加聚可以生成
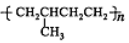
难度: 中等查看答案及解析
-
W、X、Y、Z均为的短周期元素,原子序数依次增加, W的原子核外最外层电子数是次外层的2倍, X-、Y+具有相同的电子层结构, Z的阴离子不能发生水解反应。下列说法正确的是
A. 原子半径:Y>Z>X>W
B. 简单氢化物的沸点: Z>X>W
C. 最高价氧化物的水化物的酸性:W<Z<X
D. X与Y两种元素组成的化合物是离子化合物
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基
B. 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚
C. 向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂
D. 使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙,说明Ksp[Ca5(PO4)3F]< Ksp[Ca5(PO4)3OH]
难度: 中等查看答案及解析
-
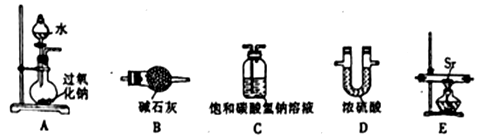
用下列装置进行相应实验,能达到实验目的的是
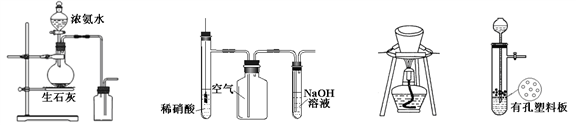
图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是
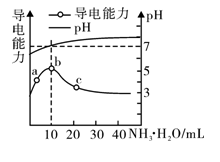
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
难度: 中等查看答案及解析