-
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
目的
古 代 文 献
说明
A
使用
“…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”——《天工开物》
KNO3能自燃
B
鉴别
区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”。——《本草经集注》
利用焰色反应
C
提纯
“…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》
溶解,蒸发结晶
D
性质
“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者” ——《本草纲目》
利用KNO3的氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g)
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)
CaO(s)+SO3(g)的焓变
难度: 困难查看答案及解析
-
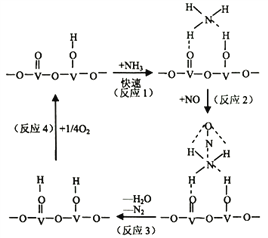
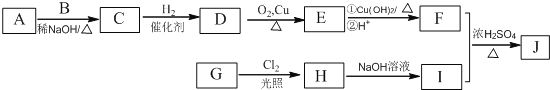
药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。则下列说法正确的是

A. 根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B. 上述各物质中能发生水解反应的有A、B、D、G
C. G的同分异构体中属于酯且能发生银镜反应的有2种
D. 1molA能与lmolNaOH反应
难度: 中等查看答案及解析
-
下列各组描述正确的是
A. 化工生产要遵守三原则:充分利用原料、充分利用能量、保护环境。①燃烧时使用沸腾炉②制硫酸时使用热交换器③制盐酸时将氯气通入燃烧的氢气中,这3种化工生产分别符合以上某原则
B. ①用燃烧的方法鉴别甲烷、乙烯和乙炔②用酒精萃取溴水中的溴③用水鉴别硝酸铵和氢氧化钠固体④用互滴法鉴别Na2CO3、盐酸、BaCl2、NaCl四种溶液以上均能达到实验目的
C. ①用硫粉覆盖地下撒有的汞②金属钠着火用泡沫灭火器或干粉灭火器扑灭③用热碱溶液洗去试管内壁的硫④用湿的红色石蕊试纸检验氨气是否集满 以上操作均合理
D. ①过氧化氢:火箭燃料②碳酸氢钠:食品发酵剂③钠:制氢氧化钠④硫酸:制蓄电池 以上物质的用途均合理
难度: 困难查看答案及解析
-
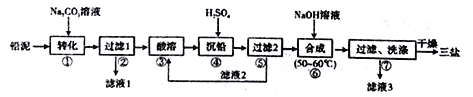
某小组设计如图所示装置(夹持装置略去),在实验室模拟候氏制碱工艺中NaHCO3的制备。下列说法不正确的是
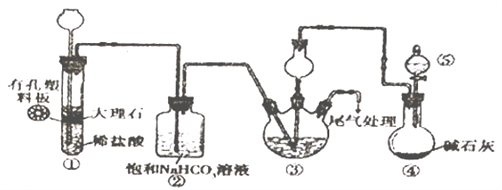
A. 应先向③中通入足量NH3,再通入足量CO2
B. 装置①也可用于制H2
C. ③中反应的离子方程式为NH3+CO2+H2O=NH4++HCO3-
D. ③、⑤中应分别盛放饱和食盐水和浓氨水
难度: 中等查看答案及解析
-
25℃时,用浓度均为0.1 mol/L的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol/L的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是

A. HA为弱酸,BOH为强碱
B. a点时,溶液中离子浓度存在关系: c(B+)>c(Cl-)>c(OH-)>(BOH)
C. b点时两种溶液中水的电离程度相同,且V=20
D. c、d两点溶液混合后微粒之间存在关系: c(H+)= c(OH-)+ c(BOH)
难度: 困难查看答案及解析