-
下列有关化学用语使用正确的是
A.次氯酸的结构式:H—Cl—O
B.CO2的比例模型
C.NH4Cl的电子式:
D.苯乙烯的结构简式:
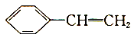
难度: 简单查看答案及解析
-
下列实验操作中,仪器一定需要插入液面以下的
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管
②制备氢气的简易装置中的长颈漏斗
③分馏石油时控制温度所用的温度计
④用乙醇制备乙烯时所用的温度计
⑤向BaCl2溶液中滴加稀硫酸所用的胶头滴管
A.③⑤ B.②⑤ C.①②④ D.①②③④⑤
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A.SO42- B.Na+ C.Ba2+ D.NH4+
难度: 中等查看答案及解析
-
要组装一套实验室利用液体和液体反应制备气体的装置,现设计了如下的五步操作,正确的顺序是
①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定好铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中 ④检查装置的气密性(利用固定装置微热的方法检查装置的气密性)⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③ C.①②⑤④③ D.①⑤④②③
难度: 中等查看答案及解析
-
将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.催化剂 B.漂白剂 C.还原剂 D.氧化剂
难度: 简单查看答案及解析
-
下列说法正确的是
A.7.8gNa2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA
B.用铜做电极电解CuSO4溶液的反应方程式:2Cu2++2H2O
2Cu+O2↑+4H+
C.等质量的N2和CO所含原子数均为2NA
D.pH等于2的醋酸溶液中加入0.01mol/L的盐酸,溶液pH会变小
难度: 中等查看答案及解析
-
今有如下三个热化学方程式:
H2(g)+1/2O2(g)═H2O(g)△H=a kJ•mol-1
H2(g)+1/2O2(g)═H2O(l)△H=b kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1
关于它们的下列表述,正确的是
A.它们都是吸热反应 B.氢气的燃烧热为△H=akJ•mol-1
C.反应热的关系:a=b D.反应热的关系:2b=c
难度: 中等查看答案及解析
-
下列实验现象预测正确的是

A.实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明
B.实验Ⅱ:铁片最终完全溶解,且高锰酸钾溶液变无色
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终无明显变化
D.实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象
难度: 中等查看答案及解析
-
某研究小组通过实验探究金属及其化合物的性质,操作正确且能达到目的的是
A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色
B.向煮沸的1mol/LNaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿
难度: 中等查看答案及解析
-
甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质。已知:A+B=D+F,A+C=E+F; 0.1mol•L-1D溶液的pH为13(25℃).下列说法正确的是
A.原子半径:丁>丙>乙>甲
B.1mol A与足量B完全反应共转移了2mol电子
C.丙元素在周期表中的位置为第二周期第ⅣA族
D.由甲、乙、丙、丁四种短周期元素组成的盐,其水溶液既有呈酸性的,也有呈碱性的
难度: 困难查看答案及解析
-
C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及化合物的说法中正确的是
A.三种元素在自然界中既有游离态又有化合态
B.氧化物都属于酸性氧化物,能与碱反应
C.最低价的气态氢化物都具有还原性,一定条件下可与O2发生反应
D.其最高价氧化物对应水化物的酸性强弱:H2SO4>H2SiO3>H2CO3
难度: 中等查看答案及解析
-
已知X、M都是中学教材中常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n+Xn+H+--X单质+H2O(未配平);(乙)Mm++mOH-→M(OH)m↓
①若n=1,则XO3n中X元素为+5价,X位于周期表第VA族
②若n=2.则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m。
A.①③ B.②③ C.①② D.③④
难度: 困难查看答案及解析
-
科学家预言超级原子的发现将会重建周期表,2015年1月美国科学在《Science》是发表论文,宣布发现了A1的超原子结构A113和A114,Al13、Al14的性质很像现行周期表中的某主族元素,己知这类超原子当具有40个价电子时最稳定(例Al原子具有3个价 电子).下列说法不正确的是
A.Al14有42个价电子,且与IIA族元素性质相似
B.Al13有39个价电子,且与卤素性质类似
C.Al13、Al14 互为同素异形体
D.Al13原子中存在离子键
难度: 中等查看答案及解析
-
碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。高温下这两种化合物均能分解成氧化铜。在高温下这两种化合物均能分解成氧化铜.溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是
A.35g B.30g C.20g D.15g
难度: 困难查看答案及解析
-
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中正确的是
A.O2与Cu反应生成CuO,S与Cu反应生成CuS
B.CaC2能水【解析】
CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水【解析】
Al4C3+12H2O=4Al(OH)3+3CH4↑C.根据化合价Fe3O4可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3
D.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀
难度: 困难查看答案及解析
-
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、K2CO3、 BaCO3
D.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32、AlO2-、Al(OH)3
难度: 困难查看答案及解析