-
化学与生活息息相关,下列说法正确的是
A. 食盐可作调味剂,也可以用作食品防腐剂
B. 碳酸钾有一定的去污能力,在热水中去污能力会减弱
C. 煤经过气化和液化等变化后,可以减少PM2.5引起的污染
D. 根据纤维燃烧产生的气味,不能确定是否为蛋白质纤维
难度: 简单查看答案及解析
-
下列有机反应中属于加成反应的是
A. 苯和液溴在FeBr3催化作用下反应生成溴苯
B. 乙烯使酸性高锰酸钾溶液褪色
C. 乙烯与HC1气体反应生成一氯乙烷
D. 丙烯和氯气在一定条件下反应生成CICH2CH =CH2
难度: 中等查看答案及解析
-
某有机物分子中含有羟基,不考虑羟基与氯原子连在同一个碳原子上的情况,分子式为 C4H9ClO的有机物的同分异构体共有
A. 8种 B. 9种 C. 10种 D. 12种
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
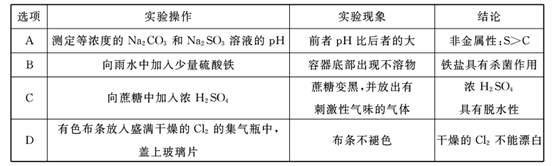
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族, B、C、D.E同周期,B的核外电子数为C的1/2,D的最外层电子数为C、E之和的一半。 下列说法正确的是
A. A、B能形成离子化合物,且A离子半径小于B离子半径
B. A、D能形成离子化合物DA5,与水反应可产生两种气体
C. C、D的简单氢化物中只有D溶于水,其水溶液呈酸性
D. E形成的两种氢化物中所有化学键种类完全相同
难度: 中等查看答案及解析
-
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2=NaBO2 +6H2O,有关的说法不正确的是
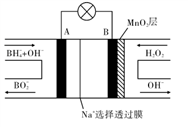
A. 纳米MnO2层的作用是提高原电池的工作效率
B. 放电过程中,Na+从B极区移向A极区
C. 电池负极的电极反应为:BH4 +8OH- - 8e一 =BO2-+6H2O
D. 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol
难度: 困难查看答案及解析
-
下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,
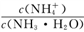 将减小
将减小难度: 困难查看答案及解析
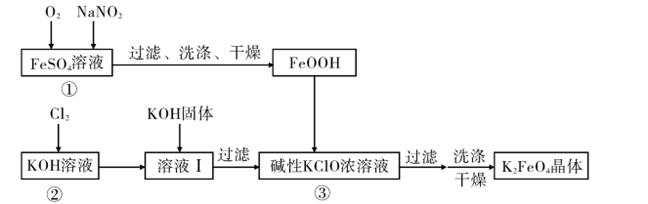
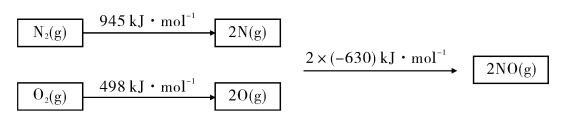
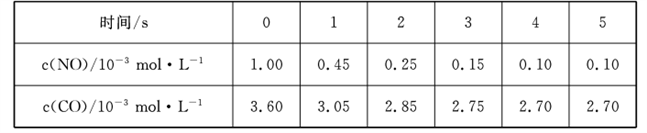
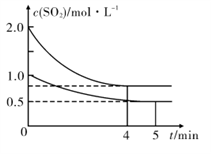

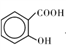 ____(填“高”或“低”);原因是______________________.
____(填“高”或“低”);原因是______________________.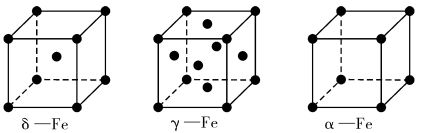
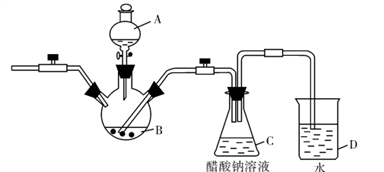
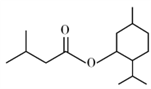 )是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
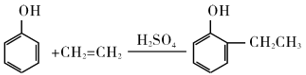 ;
;