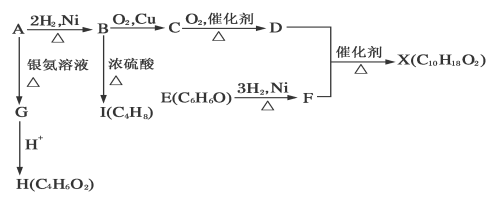
-
下列各组物质中,全部属于纯净物的是
A.汽油、油酸、聚乙烯 B.碳酸、盐酸、冰醋酸
C.甘油、乙醇钠、乙酸乙酯 D.福尔马林、食盐、酒精
难度: 简单查看答案及解析
-
下列化合物分别与金属钠反应,其中反应最慢的是
A.CH3CH2OH B.CH3COOH C.H2O D.C6H5OH
难度: 简单查看答案及解析
-
在中和热测定的实验中不需要用到的仪器是
A.量筒 B.温度计 C.环形玻璃搅拌棒 D.托盘天平
难度: 简单查看答案及解析
-
升高温度,下列数据不一定增大的是
A.电离平衡常数Ka B.水解平衡常数Kb
C.化学平衡常数K D.水的离子积常数Kw
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.在密闭容器中通入水蒸气
B.升温
C.保持压强不变,充入氦气使容器体积增大
D.保持体积不变,充入氦气使体系压强增大
难度: 中等查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g) △H ,若该反应在一定条件下能自发,则有关该反应的△H、△S判断正确的是
A.△H <0 △S<0 B.△H<0 △S>0
C.△H>0 △S<0 D.△H>0 △S>0
难度: 中等查看答案及解析
-
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 简单查看答案及解析
-
下列电离或水解方程式正确的是
A.Na2SO3的水【解析】
SO32-+ 2H2OH2SO3 + 2OH-
B.NaHCO3的电离:NaHCO3
Na + + H+ + CO32-
C.KHS溶液中HS-的电离:HS- + H2O
H3O+ + S2-
D.NaClO溶液与FeCl2溶液混合:2ClO- + Fe2+ + 2H2O = 2HClO + Fe(OH)2↓
难度: 简单查看答案及解析
-
下列描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H= + 2×283.0 kJ·mol-1
C.牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀
D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH
难度: 简单查看答案及解析
-
下列各组离子一定可以大量共存的是
A.在含大量Al3+的溶液中:NH4+、Na+、HCO3-、SO42-
B.能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、Cl-
C.在水电离出的c(H+) =10-13mol·L-1 的溶液中:NH4+、AlO2-、SO42-、NO3-
D.加Al粉能放H2的溶液中: K+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
某学生欲完成2HCl+2Ag====2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验装置是
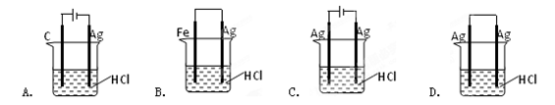
难度: 简单查看答案及解析
-
将CH3COOH和H18O—C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后的有关说法正确的是
A.18O存在于所有物质里
B.18O仅存在于乙醇和乙酸乙酯里
C.18O仅存在于乙醇和水里
D.只有乙酸乙酯分子中含18O
难度: 简单查看答案及解析
-
一定温度下,pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则该电解质可能是
A.NaCl B.H2SO4 C.CuCl2 D.Na2SO4
难度: 简单查看答案及解析
-
可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
难度: 简单查看答案及解析
-
下列实验操作中,正确的是
A.在CuSO4溶液中滴入少量NaOH溶液,来配制新制Cu(OH)2
B.在稀氨水中逐渐加入稀的硝酸银溶液来配制银氨溶液
C.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层
D.溴乙烷在氢氧化钠存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在
难度: 简单查看答案及解析
-
苯乙酸同分异构体中属于酯类的有几种
A.4种 B.5种 C.6种 D.7种
难度: 困难查看答案及解析
-
pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX一定是弱酸 B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX可能是强酸 D.反应过程中二者生成H2的速率相同
难度: 中等查看答案及解析
-
在三个烧杯中分别盛有海水,依次插入(1)铁片;(2)导线相连的铜、铁片;(3)导线相连的锌、铁片,铁被腐蚀的速度由快到慢的顺序是
A.(2)(1)(3) B.(2)(3)(1)
C.(1)(2)(3) D.(3)(2)(1)
难度: 简单查看答案及解析
-
当用碱滴定酸时,下列操作中可能使测定结果(酸的浓度)偏低的是
A.滴定后读取标准液体积时仰视
B.锥形瓶用蒸馏水洗后,未干燥
C.碱式滴定管用蒸馏水洗后,未用标准液润洗
D.滴定至溶液呈浅红色后,未等到半分钟立即开始读数
难度: 简单查看答案及解析
-
关于溶液中微粒的浓度,下列说法正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
B.等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na+) + c(H+) = c(HSO3-) + c(ClO-) + c(SO32-) + c(OH-)
C.等浓度等体积的NaHCO3溶液与NaCl溶液混合后:1/2 c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
D.标况下,将2.24L SO2气体通入到100ml 1mol·L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中:c(Na+) > c(HSO3-) > c(SO32-) >c(H+) > c(OH-)
难度: 困难查看答案及解析
-
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是
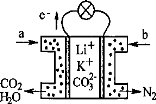
A.a为CH4,b为CO2
B.CO32﹣向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为:O2+2CO2+4e﹣=2CO32﹣
难度: 中等查看答案及解析
-
关于浓度均为0.1 mol·L-1的三种溶液:① 氨水、② 盐酸、③ 氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是
A.甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质的量浓度的10倍
B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
C.物质的量浓度c(甲)>10c(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
难度: 中等查看答案及解析
-
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
难度: 中等查看答案及解析
-
25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl
Ag2SO4
Ag2S
AgBr
AgI
1.8×10-10
1.4×10-5
6.3×10-50
7.7×10-13
8.51×10-16
下列说法正确的是
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C.在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
难度: 中等查看答案及解析