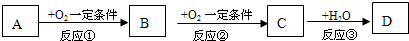-
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液.
A.①
B.③
C.②③
D.①③④难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮咬能够引起铅中毒
B.化学反应的过程中除了有物质的变化外还伴随着能量的变化
C.胶体与溶液的分离可用滤纸过滤的方法
D.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火难度: 中等查看答案及解析
-
黑火药爆炸的反应为:2KNO3+3C+S=K2S+N2↑+3CO2↑,此反应的氧化剂是( )
A.只有KNO3
B.KNO3和S
C.只有S
D.KNO3和C难度: 中等查看答案及解析
-
下列说法正确的是( )
A.光导纤维的主要成份是硅
B.常用氢氟酸(HF)来刻蚀玻璃
C.制普通玻璃的主要原料是烧碱、石灰石、石英
D.实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液难度: 中等查看答案及解析
-
将过量的CO2分别通入下列溶液中,最终有沉淀析出的溶液是( )
①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液.
A..①②③④
B..只有②④
C.只有①②③
D.只有②③难度: 中等查看答案及解析
-
关于下列各实验装置的叙述中,不正确的是( )
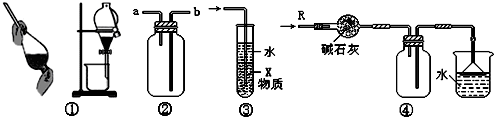
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作中,正确的是( )
A.用浓NaOH溶液和蓝色石蕊试纸来检验溶液中有无NH4+
B.向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸来制备Fe(OH)3胶体
C.为鉴别NaNO3、Al(NO3)3和Mg(NO3)2溶液,向三种溶液中滴加NaOH溶液至过量
D.除去乙酸乙酯中少量的乙酸,用饱和氢氧化钠溶液洗涤后分液难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.光照氯水时有气泡逸出,该气体是Cl2
B.燃煤时加入适量石灰石,可减少废气中SO2的量
C.NH3易液化,液氨常用作制冷剂
D.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅难度: 中等查看答案及解析
-
下表所列各组物质中,各物质间能按照如图所示通过一步反应就能完成转化的是( )
a b c A Cu CuSO4 Cu(OH)2 B HNO3 NO NO2 C Fe Fe3O4 Fe(OH)3 D Si SiO2 H2SiO3
A.选项A
B.选项B
C.选项C
D.选项D难度: 中等查看答案及解析
-
下列反应的离子方程式的书写中,正确的是( )
A.向氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O
D.将少量二氧化硫气体通入次氯酸钠溶液中:SO2+2ClO-+H2O=SO32-+2H++2Cl-难度: 中等查看答案及解析
-
若NA为阿伏加德罗常数的值,下列说法中,正确的是( )
A.1mol Na2O2与CO2完全反应,转移的电子总数为2NA
B.34 g氨气中含有12 NA个N-H键
C.常温常压下,1mol氦气含有的原子数为NA
D.标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA难度: 中等查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )

A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀,后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色难度: 中等查看答案及解析
-
25℃时,下列各离子组中,在某酸性溶液中能大量共存的是( )
A.Ca2+、Al3+、Na+、NO3-
B.Fe3+、Cu2+、Cl-、HCO3-
C.K+、Na+、SO32-、SO42-
D.K+、Ba2+、I-、NO3-难度: 中等查看答案及解析
-
下列物质的检验,其结论一定正确的是( )
A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,沉淀不溶解,则该溶液中一定含有SO42-
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中至少有SO32-和CO32-中的一种
C.取少量Na2SO3样品于试管中加水溶解后加入盐酸有气体产生,再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化
D.能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2难度: 中等查看答案及解析
-
现有M、N、P、E四种元素,有以下反应:(1)在水溶液中,M+N2+═M2++N,(2)P+2H2O(l)═P(OH)2+H2↑,(3)N、E相连浸入稀H2SO4中,电极反应:N-2e-═N2+,2H++2e-═H2↑,判断元素的还原性由强到弱的顺序是( )
A.M、N、P、E
B.M、N、E、P
C.P、M、N、E
D.E、P、M、N难度: 中等查看答案及解析
-
向200mL 0.1mol/L FeCl2溶液中加入适量NaOH,使Fe2+恰好完全沉淀,小心加热此混合物,直到水分蒸干,然后灼烧到质量不再变化,此时固体的质量为( )
A.1.6g
B.2.34g
C.3.94g
D.5.00g难度: 中等查看答案及解析
-
已知:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,对于该反应的下列叙述中,不正确的是( )
A.氧化剂和还原剂的物质的量之比为1:3
B.离子间的反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1molNO3-发生氧化反应,转移3mole-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+难度: 中等查看答案及解析
-
在100mL含等物质的量的HBr和H2SO3的溶液里通入0.025mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 ).则原溶液中HBr和H2SO3的浓度都等于( )
A.0.25mol•L-1
B.0.002mol•L-1
C.0.02mol•L-1
D.0.2mol•L-1难度: 中等查看答案及解析