-
化学与生产、生活、科技等密切相关,下列物质与其用途完全符合的是( )
①Na2O2—供氧剂 ②晶体Si—太阳能电池 ③AgI—人工降雨 ④NaCl—制纯碱
⑤Al2O3—焊接钢轨 ⑥NaClO—消毒剂 ⑦Fe2O3—红色油漆或涂料
⑧SO2—食品防腐剂 ⑨NH3—制冷剂 ⑩水玻璃—耐火材料
A.①④⑤⑧⑨
B.①②③⑥⑦⑨
C.①②③④⑥⑦⑨⑩ D.①②③④⑥⑦⑨
难度: 简单查看答案及解析
-
下列关于化学用语的表示正确的是( )
A.过氧化钠的电子式:

B.质子数为35、中子数为45的溴原子:
C.硫离子的结构示意图:
D.甲酸甲酯的结构简式:C2H4O2
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.常温常压下,44g丙烷含有共价键的数目为9NA
B.标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA
C.电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠
D.1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl- 一定能够大量共存
C.利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
D.除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层
难度: 中等查看答案及解析
-
新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:( )
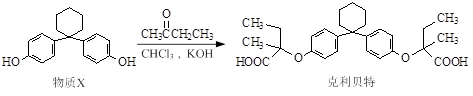
下列有关叙述正确的是
A.克利贝特的分子式为C28H34O6
B.物质X分子中所有碳原子可能位于同一平面内
C.用饱和NaHCO3溶液可以鉴别物质X和克利贝特
D.1 mol物质X最多可以与含2 molBr2的溴水反应
难度: 中等查看答案及解析
-
X、Y、M、N是短周期且原子序数依次增大的主族元素。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列有关说法正确的是( )
A. M、N的简单离子半径:r(N-)>r(M2﹣)
B. 气态氢化物的稳定性:M>X
C. X、Y形成的化合物中只有离子键
D. X、Y、N所形成化合物的水溶液可能显中性或碱性
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A.
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B.
向饱和Na2CO3溶液中通CO2
有晶体析出
溶解度:
NaHCO3< Na2CO3
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将10mL 0.1mol·L-1NaOH溶液滴入1 mL 0.1mol·L-1MgSO4溶液中,再滴加0.1mol·L-1 CuSO4溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
难度: 困难查看答案及解析


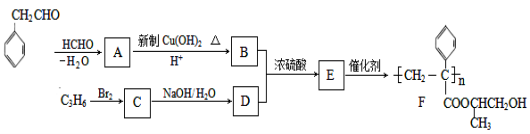
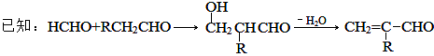
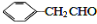 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比