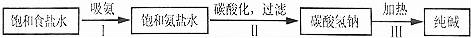-
实验室中有两瓶失去标签的稀盐酸和氯化钠溶液,下列四种试剂中能将其鉴别出来的是( )
A.AgNO3溶液 B.无色酚酞试液 C.K2CO3溶液 D.Na2SO4溶液
难度: 中等查看答案及解析
-
推理和归纳是化学学习和研究中常用的思维方法。下列推理正确的是
A.稀有气体可做保护气,可做保护气的一定是稀有气体
B.单质是由一种元素组成的物质,由一种元素组成的物质一定是单质
C.性质活泼的金属在空气中容易被腐蚀,铝在空气中不易被腐蚀是因为其性质不活泼
D.酸能跟碱反应生成盐和水,能跟碱反应生成盐和水的物质不一定是酸
难度: 困难查看答案及解析
-
下列物质露置于空气中,因发生化学变化而使其质量增加的是( )
A.浓硫酸 B.烧碱溶液 C.浓盐酸 D.过氧化氢溶液
难度: 中等查看答案及解析
-
对下列事实的解释,不合理的是( )
A.通过气味辨别氮气和氨气 分子是运动的,不同分子的性质不同
B.氧气经压缩储存在钢瓶中 压强增大,分子之间的间隔变小
C.干冰升华为二氧化碳气体 状态变化,分子大小随之变化
D.蔗糖在热水中溶解更快 温度越高,分子运动速率越大
难度: 中等查看答案及解析
-
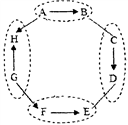
如图是五种粒子的结构示意图,下列说法错误的是( )
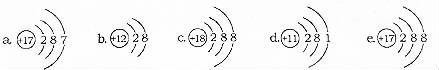
A.图中粒子共能表示四种元素
B.图中表示阴离子的是c、e
C.图中b粒子的化学符号为Mg2+
D.图中d粒子在化学反应中易失去电子
难度: 困难查看答案及解析
-
如图表示了初中化学中一些常见物质的相互转化关系(部分反应条件已省略).下列说法错误的是( )
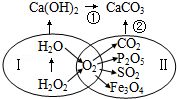
A.圈Ⅰ中发生的反应可能都是分解反应
B.利用反应②可用来检验二氧化碳气体
C.圈Ⅱ中的化学反应说明氧气具有可燃性
D.利用反应①可制得烧碱
难度: 中等查看答案及解析
-
科学家采用“组合转化”技术,可将二化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )
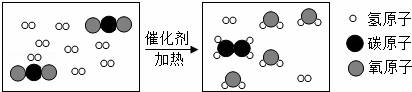
A.参加反应的两种分子的个数比是1:4
B.无机物在一定条件下可转化为有机物
C.反应前后原子种类、数目均不变
D.乙烯的化学式为C2H4
难度: 中等查看答案及解析
-
下列有关实验现象的描述,正确的是
A.铁丝在氧气中剧烈燃烧,火星四射,生成白色固体
B.分别点燃一小块棉纤维和羊毛纤维,都产生烧焦羽毛的气味
C.测定空气中氧气含量的实验里,铜丝加热变黑
D.一氧化碳高温还原氧化铁时,红色粉末逐渐变为银白色
难度: 简单查看答案及解析
-
如图是A、B、C三种固体物质的溶解度曲线.下列分析不正确的是( )
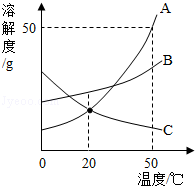
A.50℃时,三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时,把50gA放入50g水中能形成75gA的饱和溶液
C.将C的饱和溶液变为不饱和溶液,可采用降温的方法
D.分别将三种物质的饱和溶液从50℃将至20℃时,所得溶液溶质质量分数大小关系是B>C=A
难度: 中等查看答案及解析
-
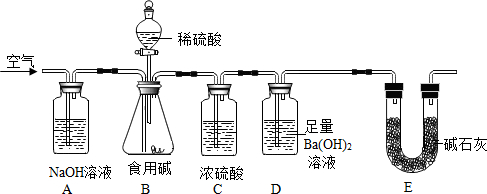
物质的分离、提纯对于人类的生产、生活和科学研究具有十分重要的意义,下面除去物质中杂质的方法,正确的是( )
A.碳酸氢钠固体中含有少量碳酸钠 将固体充分加热
B.硫酸锌溶液中混有少量硫酸铜 加入过量铁粉
C.二氧化碳气体中含有少量氯化氢 通过足量饱和碳酸氢钠溶液
D.氯化钠溶液中混有少量硫酸钠 加入适量氢氧化钡溶液
难度: 困难查看答案及解析
-
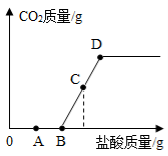
某溶液可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。下列相关说法正确的是
A.加入氢氧化钡溶液至过量,共发生了三个化学反应
B.该溶液一定含有盐酸、氯化铜,可能含有硝酸钠
C.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡
D.到达b点时所消耗氢氧化钡溶液中溶质的质量是17.1g
难度: 中等查看答案及解析
-
向一定质量AgN03和Cu(N03)2的混合溶液中加入过量的 Zn粉,溶液质量随反应时间变化的情况如图所示。下列说法正确的是( )

A.取a点溶液,滴加稀盐酸,无白色沉淀
B.图标上b〜c段质量增加的原因是Zn与Cu(N03)2溶液反应
C.b点时溶液中金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、Ag
D.c点和d点溶质种类不同,金属单质种类也不同
难度: 中等查看答案及解析
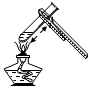 B. 测溶液的pH
B. 测溶液的pH 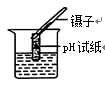
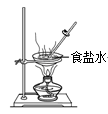
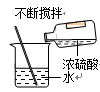 D. 蒸发食盐水
D. 蒸发食盐水