-
元素性质呈周期性变化的原因是( )
A. 相对原子质量逐渐增大 B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化 D. 元素的化合价呈周期性变化
难度: 简单查看答案及解析
-
下列化学用语的使用正确的是( )
A. N2的结构式: N≡N B. CO2的比例模型:
C. 氯化氢的电子式
D. F的原子结构示意图:
难度: 简单查看答案及解析
-
科学家制造出由4个氧原子构成的氧分子,并用质谱仪探测后证实了它的存在。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
A. 是氧元素的一种同位素 B. 是臭氧的同分异构体
C. 是一种新的氧化物 D. 是氧气的同素异形体,分子内含有共价键
难度: 中等查看答案及解析
-
下列物质中含有Cl-的是( )
A. 液态氯化氢 B. 次氯酸钠溶液
C. 固体氯化钠 D. 四氯化碳
难度: 简单查看答案及解析
-
下列物质发生变化时,所克服粒子间相互作用力属于同类型的是( )
A. 碘和干冰的升华 B. 食盐和乙醇分别溶解在水中
C. 硫和金属钠的熔化 D. 金刚石和氢氧化钠的熔化
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. CO2、NH3、BF3 中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 常温常压下,HCl、H2O、CO2的状态不同是因为所含的共价键不同
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
难度: 中等查看答案及解析
-
下列叙述中能肯定A金属比B金属活泼性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子电子层数比B原子的电子层数多
C. 常温时,A能从水中置换出氢,而B不能
D. 1 mol A从酸中置换H+ 生成的H2比1 mol B从酸中置换H+ 生成的H2多
难度: 中等查看答案及解析
-
下列有关环境污染的叙述错误的是( )
A. 酸雨通常是指pH在7以下的降水
B. 氮氧化物是造成光化学烟雾的主要原因
C. 大气污染主要指CO、SO2、氮氧化物以及粉尘等
D. N与S的氧化物直接危害人的身体健康,引发呼吸道疾病
难度: 简单查看答案及解析
-
对于下列事实的解释错误的是( )
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 氨水可使酚酞试剂变为红色,说明氨溶解于水显弱碱性
难度: 中等查看答案及解析
-
工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
难度: 中等查看答案及解析
-
下列除杂的操作方法,正确的是( )
A. NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶
B. 食盐中混有少量NH4Cl:加过量烧碱溶液后加热蒸干
C. NO中混有少量NO2气体:用水洗涤后再干燥
D. 硝酸混有少量硫酸:加适量BaCl2后再过滤
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
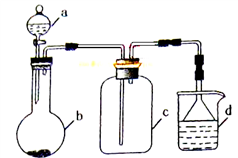
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.A13+、CH3COO-、C1- B.Na+、NH4+、C1-
C.Mg2+、C1-、Fe2+ D.Mg2+、Ba2+、Br-
难度: 中等查看答案及解析
-
下列有关物质的检验或区分方法中正确的是( )
A. 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42—
B. 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+
C. 向某溶液滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可确定原溶液中无NH4+
D. 向某溶液中加入足量的盐酸,放出二氧化碳气体,可证明该溶液中一定含有碳酸盐
难度: 中等查看答案及解析
-
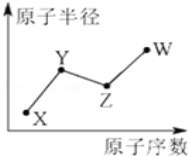
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3- >D->B+>A2+ D. 还原性D- >C3-
难度: 中等查看答案及解析
-
下表中给出几种氯化物的熔点和沸点:

有关表中所列四种氯化物的性质,有以下叙述:
①氯化钠晶体中微粒间以分子间作用力结合;②工业上可以用电解熔融的氯化镁制取镁;③氯化铝在加热时能升华;④氯化铝晶体是典型的离子晶体;⑤四氯化硅在晶态时属于分子晶体。其中,正确的是( )
A. ①② B. ③④ C. ③⑤ D. ②③⑤
难度: 中等查看答案及解析
-
下列对一些实验事实和理论解释正确的是( )
选项
实验事实
理论解释
A
HCl气体溶于水,能电离出H+、Cl-
HCl为离子化合物
B
HBr的酸性强于HCl的酸性
Br的非金属性比Cl强
C
HF的沸点高于HCl
F的非金属性比Cl强
D
K3C60在熔融状态下能够导电
K3C60中含有离子键
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在铁铜的混合物中,加入一定量的稀硝酸并微热,充分反应后,剩余金属a g,再向其中加入一定量的稀盐酸并加热,充分振荡后,还剩余金属b g ,则 ( )
A. a可能等于b B. a一定等于b C. a可能小于b D. a一定大于b
难度: 中等查看答案及解析
-
某条件下,锌与稀硝酸反应时,其物质的量之比2:5,则此时硝酸的还原产物是( )
A. N2O B. NO2 C. NO D. NH4NO3
难度: 困难查看答案及解析
-
1L稀H2SO4 和稀H NO3的混合液,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
A.2.4g B.3.2g C.6.4g D.9.6g
难度: 简单查看答案及解析

 (信息提示:品红能溶解在酒精中形成红色溶液;H2SO3是二元弱酸)
(信息提示:品红能溶解在酒精中形成红色溶液;H2SO3是二元弱酸)
