-
对发现元素周期律贡献最大的化学家是 ( )
A.牛顿 B.道尔顿 C.阿伏加德罗 D.门捷列夫
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C. H2O D.H2
难度: 简单查看答案及解析
-
下列物质不属于有机物的是( )
A. 乙酸 B. 碳酸钠 C. 乙醇 D. 乙烯
难度: 简单查看答案及解析
-
下列比较或归纳正确的是( )
A.稳定性:NH3<PH3<ASH3
B.离子半径:Cl->S2->Al3+
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:Be(OH)2>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数: X<Y B.原子半径:X<Y
C.离子半径:X>Y D.原子最外层电子数:X<Y
难度: 中等查看答案及解析
-
下列反应中,不属于取代反应的是( )
A.在催化剂存在条件下苯与溴反应制溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙烯与溴生成1,2二溴乙烷
D.在光照条件下甲烷和氯气反应制氯仿
难度: 简单查看答案及解析
-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
难度: 中等查看答案及解析
-
下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )
A.6和8 B.19和16 C.12和17 D.10和8
难度: 中等查看答案及解析
-
Se是人体必需微量元素,下列有关
Se和
Se的说法正确的是( )
A.
Se 和
Se所含电子数不同
B.
Se和
Se是两种不同的核素
C.
Se和
Se 分别含有44和46个质子
D.
Se和
Se都含有34个中子
难度: 简单查看答案及解析
-
正确掌握化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体
B.氨分子中的化学键为非极性共价键( )
C.NH4Cl的电子式:
D.S2-的结构示意图:
难度: 简单查看答案及解析
-
下列物质中不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②苯 ③乙醇 ④甲烷 ⑤乙酸 ⑥二氧化硫
A.①②③④⑤ B.②④⑤ C.②④⑤⑥ D.①③⑥
难度: 简单查看答案及解析
-
某有机化合物6.2 g在氧气中完全燃烧,只生成8.8 g CO2和5.4 g H2O。下列说法正确的是( )
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:4
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A.左、下方区域的金属元素
B.金属元素和非金属元素分界线附近的元素
C.右、上方区域的非金属元素
D.稀有气体元素
难度: 简单查看答案及解析
-
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
A.Na[Au(CN)2]不溶于水
B.化合物Na[Au(CN)2]中金元素的化合价为+1
C.金元素在地壳中能以化合态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
难度: 中等查看答案及解析
-
在一定温度下,可逆反应A(气)+3B(气)
2C(气)达到平衡的标志是( )
A.A、B、C的分子数比为1:3:2
B.A、B、C的浓度相等
C.C生成的速率与C分解的速率相等
D.单位时间生成n mol A,同时生成3n mol B
难度: 中等查看答案及解析
-
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下:
N+
He―→
O+
H,下列叙述正确的是( )
A.
O原子核内有9个质子
B.
H原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He和N2化学性质都很稳定
难度: 简单查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A.元素非金属性按X、Y、Z的顺序减弱
B.原子的电子能力按X、Y、Z的顺序增强
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.单质的氧化性按X、Y、Z的顺序增强
难度: 中等查看答案及解析
-
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
A.IF5 + 3H2O = HIO3 +5HF
B.3IBr +2Fe = FeI3 + FeBr3
C.BrCl的氧化性强于I2
D.IBr可以与NaOH溶液反应生成2种盐
难度: 中等查看答案及解析
-
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是 ( )
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
难度: 中等查看答案及解析
-
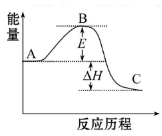
已知298 K时,合成氨反应N2(g)+3H2(g)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
难度: 中等查看答案及解析
-
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是( )
A.X是H2SO4
B.反应中Mn原子与Bi原子个数比为5:2
C.该反应中NaBiO3作氧化剂
D.该反应中Na2SO4既不是氧化产物,又不是还原产物
难度: 中等查看答案及解析
-
下列叙述中错误的是 ( )
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2O
B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全
NH4++Al3++2SO42—+2Ba2++4OH—= NH3·H2O+Al(OH)3↓+2BaSO4↓
C.FeCl3溶液腐蚀铜线路板:Fe3++Cu = Fe2++Cu2+
D.向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3—+OH—= CO32—+H2O
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
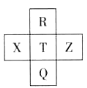
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
难度: 中等查看答案及解析
-
CH3COOH分别与CH3CH2OH和CH3CH218OH反应,生成的酯的相对分子质量关系( )
A.前者大于后者 B.前者小于后者
C.前者等于后者 D.无法判断
难度: 中等查看答案及解析
-
是常规核裂变产物之一,可以通过测定大气或水中
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的叙述中错误的是( )
A.
的化学性质与
相同 B.
的原子序数为53
C.
的原子核外电子数为78 D.
的原子核内中子数多于质子数
难度: 简单查看答案及解析
-
列关于同主族元素的说法错误的是( )
A.同主族元素随原子序数递增,元素原子的得电子能力逐渐增强
B. 同主族元素随原子序数递增,单质氧化能力逐渐减弱
C. 同主族元素原子最外层电子数都相同
D. 同主族元素的原子半径,随原子序数增大而逐渐增大
难度: 简单查看答案及解析
-
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 ( )
A.原子半径: 丁 >丙>乙
B.单质的还原性:丁>丙>甲
C.甲,乙,丙的氧化物均为共价化和物
D.乙,丙,丁的最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
Y
Z
M
X
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2 周期、第ⅥA族
难度: 中等查看答案及解析
-
下列变化为放热的化学反应的是 ( )
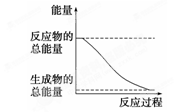
A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1
C.形成化学键时共放出862 kJ能量的化学反应
D.能量变化如右图所示的化学反应
难度: 中等查看答案及解析