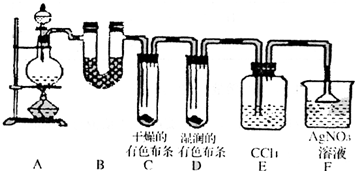
-
下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);△H=+1.9 kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ/mol难度: 中等查看答案及解析
-
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现.使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一.下列有关说法不正确的是( )
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生还原反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合难度: 中等查看答案及解析
-
下列有关化学用语表达不正确的是( )
A.氨气分子的电子式:
B.CO2分子的结构式:O=C=O
C.S2-的离子结构示意图: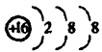
D.苯分子的比例模型:
难度: 中等查看答案及解析
-
判断反应过程的自发性的目的是( )
A.判断反应的方向
B.确定反应是否一定会发生
C.判断反应过程发生的速率
D.判断反应过程的热效应难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.制取蒸馏水是把杂质从水中蒸出
B.通过加热除去氯化铵固体中的碘单质
C.在做钠与水反应的实验时,为了安全起见,应在小烧杯上盖上表面皿或玻璃片
D.配制一定物质的量浓度的稀硫酸时,量取一定体积的浓硫酸注入小烧杯中,加水稀释冷却后转移到容量瓶中难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段.下列分类依据和结论都正确的是( )
A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
B.HClO、浓H2SO4、HNO3均具有氧化性,都是氧化性酸
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-═CO2+5H2O
C.在铁件上镀铜时,金属铜作阴极
D.电解精炼铜时,电解质溶液中铜离子浓度保持不变难度: 中等查看答案及解析
-
根据
 的结构,它不可能具有的性质是( )
的结构,它不可能具有的性质是( )
A.与新制氢氧化铜反应
B.使溴的四氯化碳溶液褪色
C.与乙醇在浓硫酸催化下发生酯化反应
D.与银氨溶液反应析出银难度: 中等查看答案及解析
-
某有机物的结构简式为:
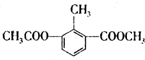 关于该物质的叙述错误的是( )
关于该物质的叙述错误的是( )
A.一个分子中含有12个H原子
B.一氯代物有4种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol难度: 中等查看答案及解析
-
如图是某些实验的部分装置,其中所注明的实验能达到实验目的是( )

A.①②
B.③④
C.①③
D.②④难度: 中等查看答案及解析
-
A、B、C短周期元素在周期表中的相对位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体A B C
②x的种类比y的多
③常温上,在10mL B的氢化物中无H+
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐.
A.①②③④
B.②③
C.①②④
D.①④难度: 中等查看答案及解析
-
类推的思维方式在化学学习与研究中是经常用到的,但是有时会产生错误的结论,因此类推出的结论最终要经过实践的验证才能决定其正确与否.以下类推的结论正确的是( )
A.Na、Mg、Al具有强还原性,Na常温下与水剧烈反应,故Mg、Al也是
B.盐酸、硝酸都是强酸,CaCO3与盐酸反应制取CO2,用硝酸也行
C.由2Fe+3Cl2=2FeCl3可推出2Fe+3I2=2FeI3成立
D.CO2和SO2都是酸性氧化物,SO2能使酸性KMnO4溶液褪色,故CO2也是难度: 中等查看答案及解析
-
25℃时,在20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,
有关粒子浓度关系的比较中,不正确的是( )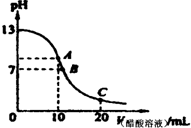
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)═c(H+),c(Na+)═c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)═2c(Na+)难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是( )
①加入Al能放出H2的溶液中:Fe2+ Al3+ NO-3 Cl- S2-
②在pH=11的溶液中:Na+ AlO-2 NO3- S2- SO2-3
③由水电离的c(H+)=10-12mol•L-1的溶液中:Cl- HCO-3 NO-3 NH+4 F-
④加入Mg能放出H2的溶液中:Mg2+ NH+4 Cl- K+ SO2-4
⑤使甲基橙变红的溶液中:Fe3+ NH+4 Cl- K+SO2-4.
A.①③④
B.①②④
C.②④⑤
D.①②⑤难度: 中等查看答案及解析
-
α1和α2分别为A、B在两个恒容容器中平衡体系A(g)⇌2B(g)和2A(g)⇌B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
A.α1、α2均减小
B.α1、α2均增大
C.α1减小,α2增大
D.α1增大,α2减小难度: 中等查看答案及解析
-
经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( )

A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动难度: 中等查看答案及解析
-
Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),在常温下KSP=2×10-20mol3/L3.在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于( )
A.2
B.3
C.4
D.5难度: 中等查看答案及解析
-
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”.工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cCaTiCl4+cCO 反应(1)
TiCl4+2MgTi+2MgCl2 反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,被还原
③在反应(1)、(2)中C的还原性大于TiCl4,Mg的还原性大于Ti
④a=1,b=c=2
⑤每生成9.6g Ti,反应(1)、(2)中共转移0.8mol e-.
A.①②④
B.②③④
C.③④
D.②⑤难度: 中等查看答案及解析