-
化学反应中通常伴随着能量变化,下列说法中错误的是
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
难度: 中等查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.
(W)=3
(Z) B.2
(X)=3
(Z)
C.2
(X)=
(Y) D.3
(W)=2
(X)
难度: 中等查看答案及解析
-
下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
A.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.3kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH =-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);ΔH =-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);ΔH =-283kJ/mol
难度: 中等查看答案及解析
-
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2 =-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q2-1.5 Q1-0.5Q3
D.1.5 Q1-0.5 Q2+0.5Q3
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是
A.2SO2+O2
2SO3;ΔH =-196.6kJ/mol
B.C(s)+O2(g)=CO2(g);ΔH =393.5kJ/mol
C.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.5kJ/mol
D.H+(aq)+OH-(aq)=H2O(l);ΔH =57.3kJ/mol
难度: 中等查看答案及解析
-
关于强弱电解质及非电解质的组合完全正确的是
A B C D
强电解质 NaCl H2SO4 CaCO3 HNO3
弱电解质 HF BaSO4 HClO CH3COOH
非电解质 Cl2 CS2 盐酸 SO2
难度: 中等查看答案及解析
-
在20mL0.1mol/L 的醋酸溶液中,能使溶液的pH减小,而且使醋酸的电离平衡向逆方向移动,可加入的试剂是
A.20mL水 B.浓盐酸 C.冰醋酸 D.NaOH溶液
难度: 中等查看答案及解析
-
在一定温度下,可逆反应:A2(气)+B2(气)
2AB(气),达到平衡的标志是
A.容器的总压强不随时间而变化
B.单位时间内有n molA2生成的同时有n molB2生成
C.单位时间内有n molB2发生反应的同时有n molAB分解
D.单位时间内生成n molA2同时就有2n molAB生成
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH- ;下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体NaOH ,平衡正向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
可逆反应:A+3B
2C+2D(各物质均为气体),在不同情况下测得有下列4 种
反应速率,其中反应最快的是
A.vD=0.4 mol / (L·s) B.v C=0.5 mol / (L·s)
C.v B=0.6 mol / (L·s) D.v A=0.15 mol / (L·s)
难度: 中等查看答案及解析
-
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH 和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是
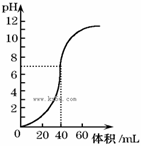
A.1 mol/L 60mL B.0.5 mol/L 80mL
C.0.5 mol/L 40mL D.1 mol/L 80mL
难度: 中等查看答案及解析
-
某温度下,X(g)+Y
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
A.正反应是吸热反应,Z是固体
B.逆反应是放热反应,Y是固体,Z为气体
C.正反应是吸热反应,只有Z不是气体
D.正反应是放热反应,Y和Z均为气体
难度: 中等查看答案及解析
-
对于一可逆反应,当确知平衡向正反应方向移动,下列说法肯定正确的是
A.反应物的转化率将提高 B.生成物的产量将增加
C.生成物的浓度将增大 D.生成物的百分含量将增大
难度: 中等查看答案及解析
-
在下列反应中:A2(g)+B2(g)
2AB(g)(正反应放热),当其达到平衡时,在下图的曲线中,符合勒夏特列原理的曲线是

A.①② B.③④ C.① D.①⑤
难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
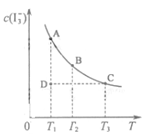
A.反应 I2(aq)+I-(aq)
I3-(aq) 的ΔH<0
B.若温度为
,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有
D.状态A与状态B相比,状态A的c(I2)大
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、Na+、SO42-
B.水电离出的c(H+) =10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+) =0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
分别在pH=2的酸和pH=12的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
A.①② B.② C.②③ D.④
难度: 中等查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时数据如下表:
容器编号
起始时各物质物质的量/mol
达平衡时体系
能量的变化
N2
H2
NH3
1
3
0
放出热量:23.15kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
难度: 中等查看答案及解析
-
向甲、乙两个容积均为1L的恒容密闭容器中,分别充入2mol A、2 mol B和1 mol A、1 mol B。相同条件下,发生下列反应:A(g)+B(g)
xC(g)
<0。测得两容器中c(A)随时间t的变化如图所示:

下列说法中正确的是
A.x可能等于2也可能等于1
B.向平衡后乙容器中充入氦气可使c(A)增大
C.将乙容器单独降温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2mol A、2 mol B,则平衡时甲容器中0.7 mol<n(B)<1.4 mol
难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示, 若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
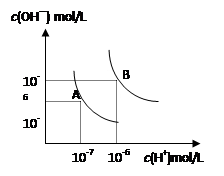
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4 溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率增大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
难度: 中等查看答案及解析
-
在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
A.3 B.5 C.6 D.8
难度: 中等查看答案及解析
-
双氧水(H2O2)和水都是极弱的电解质,但H2O2 比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:________,
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:________
难度: 中等查看答案及解析


 ,据此回答以下问题:
,据此回答以下问题: