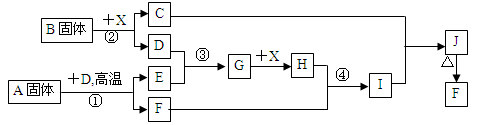
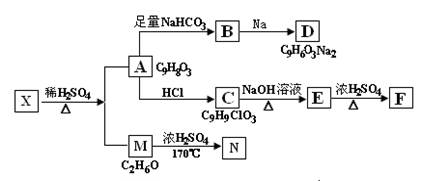
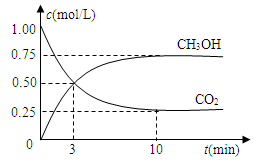
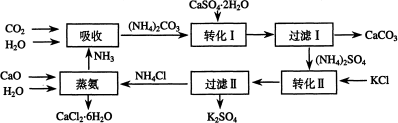
-
下列对于实验室事故的处理,合理的是( )
A.苯酚沾在手上,立即用氢氧化钠溶液洗涤 B.金属钠失火,立即用泡沫灭火器灭火
C.酒精灯失火后,立即用水扑灭 D.不慎将烧碱溶液溅到皮肤上,立即用水冲洗
难度: 简单查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+ Na+ NO-3 Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH+4 SO42- NO3-
难度: 简单查看答案及解析
-
下列反应中,有沉淀产生且不会消失的是 ( )
A.向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量
B.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量
C.向AlCl3溶液中逐滴滴入稀硫酸
D.将氨水逐滴滴入硝酸银溶液中,直至过量
难度: 简单查看答案及解析
-
在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应。所得溶液中Fe2+能被标准状况下112mL氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为( )
A.5 : 7 B.4 : 3 C.3 : 4 D.9 : 13
难度: 困难查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是 ( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③分别用NO2、NO、O2的物质的量浓度变化表示的反应速率为2:2:1的状态
④混合气体颜色不再改变的状态⑤混合气体密度不再改变的状态
⑥混合气体相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,2.24LCH4所含质子数为0.1NA
B.0.1mol Fe与足量氯气反应转移的电子数为0.2NA
C.0.1mol C8H18分子中共价键总数为2.5NA
D.100mL 1mol/L醋酸溶液中离子总数为0.2NA
难度: 困难查看答案及解析
-
下列有关二氧化硫的说法中,错误的是( )
A.二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3
B.二氧化硫能漂白某些物质,说明它具有氧化性
C.将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性
D.实验室可用浓硫酸干燥二氧化硫气体
难度: 简单查看答案及解析
-
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为( )
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
难度: 困难查看答案及解析
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
A. X2YZ4 B. XYZ3 C. X3YZ4 D. X4Y2Z7
难度: 简单查看答案及解析
-
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有 ( )
A.8种 B.14种 C.16种 D .18种
难度: 困难查看答案及解析
-
能正确表示下列化学反应的离子方程式是 ( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
难度: 中等查看答案及解析
-
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 ( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量小
B.两烧杯中参加反应的锌等量
C.甲烧杯中的酸过量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
难度: 中等查看答案及解析
-
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
( )
A.HCl和CO B.HCl、H2和CO C.CH4和NH3 D.HCl、CO和CO2
难度: 困难查看答案及解析
-
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )
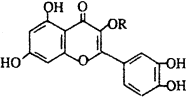
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
难度: 中等查看答案及解析