-
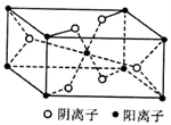
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能。下列关于石墨炔的说法不正确的是
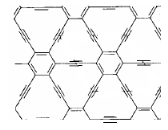
A.石墨炔属于芳香烃
B.石墨炔与金刚石互为同素异形体
C.石墨炔有望代替半导体材料硅在电子产品中得到广泛应用
D.石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜
难度: 中等查看答案及解析
-
下列有关化学用语的表示不正确的是
A.NaClO的电子式:
B.16O的原子结构示意图:
C.质子数为53,中子数为72的碘原子:125 53I
D.间羟基苯甲醛的结构简式:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Fe2+、Cl-、NO3-、K+
B.滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2-
C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO-
D.0.1mol·L-1 NaHCO3溶液中:Na+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列有关物质性质和应用正确的是
A.甲醛能使蛋白质变性,可用于食品防腐剂
B.炭具有还原性,一定条件下能将二氧化硅还原为硅
C.硅酸钠溶液呈碱性,常用作木材的防火剂
D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
难度: 中等查看答案及解析
-
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是

A.用装置甲氧化废液中的溴化氢 B.用装置乙分离CCl4层和水层
C.用装置丙分离CCl4和液溴 D.用仪器丁长期贮存液溴
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA
B.0.1mol
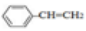 中含有双键的数目为0.4NA
中含有双键的数目为0.4NAC.标准状况下,11.2L乙醇中含有羟基的数目为0.5NA
D.4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA
难度: 中等查看答案及解析
-
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是
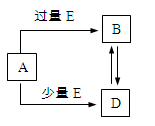
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
难度: 困难查看答案及解析
-
下列反应的离子方程式正确的是
A.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
B.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O
C.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.原子半径的大小顺序: r(X)>r(Y)>r(Z)>r(R)
B.含有Y、Z、R三种元素的化合物最多只有2种
C.元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂
D.Y与Z形成的两种化合物中的化学键和晶体类型均相同
难度: 中等查看答案及解析
-
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2
(3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
A.△H1>0,△H2<0 B.△H5=2△H2+△H3-△H1
C.△H3>0,△H5<0 D.△H4=△H1-2△H3
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀
B.CH3Cl(g)+Cl2(g)
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS)
D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率
难度: 中等查看答案及解析
-
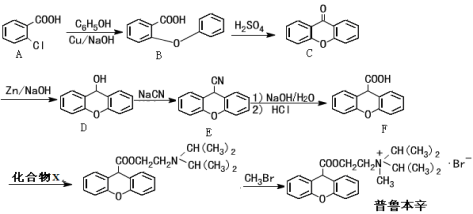
化合物C是制备液晶材料的中间体之一,它可由A和B在一定条件下制得

下列说法正确的是
A.每个A分子中含有1个手性碳原子
B.可以用酸性KMnO4溶液检验B中是否含有醛基
C.1molC分子最多可与4molH2发生加成反应
D.C可发生加成反应、取代反应、氧化反应、消去反应等
难度: 中等查看答案及解析
-
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
A.向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性
B.向该混盐中加入稀H2SO4可以产生使品红褪色的气体
C.该混盐在酸性条件下可以产生淡黄色浑浊
D.用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是
A.在0.1mol·L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4—)+c(H2C2O4)
B.向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c((CH3COO—)>c(Na+)>c(OH-)>c(H+)
C.浓度均为0. 1 mol·L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+) = 2c (CO32-) + c(OH-) + c(HCO3-)
D.浓度均为0. 1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-) =c(Na+)>c(NH4+)>c(H+)>c(OH-)
难度: 极难查看答案及解析
-
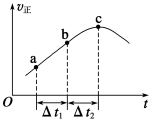
t℃时,在2L密闭、恒压容器中充入1molA和1molB,发生反应:A(g)+B(g)
C(g)。 5min后达到平衡,测得C的物质的量分数为60%,则下列说法正确的是
A.5min内平均反应速率vA=0.15mol·L-1·min-1
B.当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应
C.保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行
D.t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol
难度: 困难查看答案及解析