-
下列物质中含有共价键的离子化合物是
A.Ba(OH)2 B.CaCl2 C.H2O D.H2
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A.
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B.
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C.
除去Cu粉中混有的CuO
加入稀硝酸溶液,过滤、洗涤、干燥
D.
比较水与乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
难度: 中等查看答案及解析
-
下列说法不正确的是
A.晶体硅可用于制造太阳能电池和光导纤维
B.用饱和氯化铵溶液可以清洗金属表面的锈迹
C.“地沟油”禁止食用,但可用来制生物柴油
D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸
B.混合物:铝热剂、福尔马林、水玻璃、漂白粉
C.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
D.明矾、水银、烧碱、硫酸均为强电解质
难度: 中等查看答案及解析
-
设NA为阿伏加罗常数的值,下列叙述中正确的是
A.常温下,含1molFe的铁片与过量浓HNO3反应,转移电子的数目为3NA
B.电解饱和食盐水,当阴极产生2.24LH2时,转移的电子数为0.2NA
C.标准状况下,33.6LSO3含有9.03×1023个SO3分子
D.在46gNO2和N2O4的混合气体中所含原子总数为3NA
难度: 困难查看答案及解析
-
科学家发现了一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是
A.原子数 B.分子数 C.体积 D.物质的量
难度: 中等查看答案及解析
-
两种气态烃组成的混合气体0.1mol,完全燃烧得到0.15molCO2和3.6gH2O,下列关于该混合气体的说法正确的是
A.一定有乙烯 B.一定没有乙烯
C.一定有甲烷 D.可能有乙烷
难度: 中等查看答案及解析
-
对于反应A+3B=2C+D来说,下列反应速率中最快的是
A.v(A)=0.3mol•L-1•min-1
B.v(B)=0.6mol•L-1•min-1
C.v(C)=0.5mol•L-1•min-1
D.v(D)=0.001mol•L-1•min-1
难度: 中等查看答案及解析
-
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有
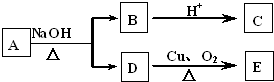
A.1种 B.2种 C.3种 D.4种
难度: 困难查看答案及解析
-
相同温度、相同浓度下的六种溶液、其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为
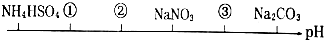
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
难度: 困难查看答案及解析
-
下列叙述不正确的是
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH-
C.氢氧燃料电池中,氢气在负极发生氧化反应
D.将地下钢管与直流电源的正极相连,用来保护钢管
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
A. 用长颈漏斗分离出乙醇与乙酸的反应产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
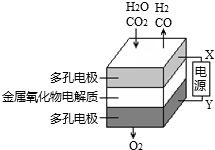
A.X是电源的负极
B.阴极的反应式是:H2O+2e-═H2+O2-,CO2+2e-═CO+O2-
C.总反应可表示为:H2O+CO2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1:1
难度: 困难查看答案及解析
-
硫化汞(HgS)难溶于水,在自然界中呈红褪色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
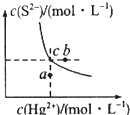
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
难度: 困难查看答案及解析
-
W、X、Y、Z均为短周期元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子之和为18。下列说法正确的是
A. 单质的沸点:W>X
B. 阴离子的还原性:W>Z
C. 氧化物的水化物的酸性:Y<Z
D. X与Y不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
一氟一氯丙烷是对臭氧层有严重破坏的一类氟氯代烃,其分子式为C3H6FCl,该物质的同分异构体有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中可能大量共存的是
①无色透明溶液中:K+、Ca2+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-4mol•L-1的溶液中:NH4+、Al3+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、Cl-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①②④ B.③⑥ C.②④ D.①③⑤⑥
难度: 中等查看答案及解析
-
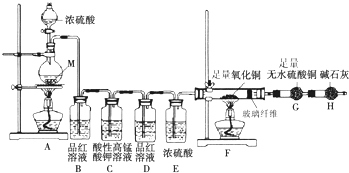
下列实验方法或装置正确的是

A. 用图1所示装置制取乙烯
B. 用图2所示方法验证HCl气体易溶于水
C. 用图3所示方法探究固体表面积对反应速率的影响
D. 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
难度: 中等查看答案及解析
-
Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述正确的是
A.正极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag+e-=Ag
C.电池放电时Cl-由负极向正极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
难度: 中等查看答案及解析
-
下图是某学校实验室从市场买回的试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸和氨水的物质的量浓度分别约为18.4mol•L-1和6.3mol•L-1
B.各取5mL与等质量的水混合后,c(H2SO4)<9.2mol•L-1,c(NH3)>6.45mol•L-1
C.各取5mL与等体积的水混合后,ω(H2SO4)<49%,ω(NH3)>12.5%
D.各取10mL于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水
难度: 困难查看答案及解析