-
2014年诺贝尔化学奖授予了美国及德国的三位化学家,以表彰他们为发展超分辨率荧光显微镜所作的贡献,开启了纳米微时代,这种开创性的成就使光学显微镜能够窥探纳米世界,可以观察类似病毒、蛋白质的微小结构,最小可分辨至2.0×10-8米,则下列说法不正确的是
A.该技术可用于观察一些胶体粒子的运动
B.该技术可用于观察一些大分子蛋白质的合成
C.该技术使观察水的分子团簇结构成为可能
D.该技术可用于分辨荧光分子中各种不同种类的原子
难度: 中等查看答案及解析
-
下列用品的有效成分及用途对应错误的是
A
B
C
D
用品




有效成分
NaCl
Na2CO3
Al(OH)3
Ca(ClO)2
用途
做调味品
做发酵粉
做抗酸药
做消毒剂
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列有关说法中正确的是
A.2.3 g Na被O2完全氧化生成Na2O和Na2O2混合物时,失去电子数为0.1~0.2 NA
B.常温下,64 g SO2所含的氧原子数为2NA
C.标准状况下,等物质的量的SO2和SO3所占体积相同
D.100 mL 0.1 mol·L-1的硫酸铝溶液中含有的Al3+为0.02NA个
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析以下8种说法,其中正确的是
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源 ③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金 ⑤盐酸和食醋均既是化合物又是酸 ⑥纯碱和熟石灰都是碱 ⑦雾、烟都是胶体 ⑧利用丁达尔效应可以区分溶液和胶体
A.①②③④⑥ B.①③④⑦⑧ C.③④⑤⑥⑦ D.①②④⑤⑧
难度: 中等查看答案及解析
-
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列说法正确的是
A.Na、Mg与水反应产生碱和氢气,Fe与在一定条件下水反应也生成碱和氢气
B.CaC2能水解:CaC2+2H2O==Ca(OH)2+C2H2↑;则Al4C3也能水解:Al4C3+12H2O ==4Al(OH)3↓+3CH4↑
C.Fe能置换硫酸铜溶液的铜;则Na也能置换硫酸铜溶液的铜
D.工业上电解熔融MgCl2的制取金属镁;则也可以用电解熔融AlCl3的制取金属铝
难度: 中等查看答案及解析
-
下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是
A.AlCl3与氨水 B.铁与稀硝酸
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
难度: 中等查看答案及解析
-
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是
A.配制过程只需要三种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D.需要称量的NaClO固体的质量为140 g
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.N2(g)+3H2(g)
2NH3(g) △H=—92.0 kJ·mol-1,吸收的能量为46.0 kJ,则形成N—H键的数目为3NA
B.常温下,向一密闭容器中加入2molNO与1molO2,容器中的分子数目小于2NA
C.18gD2O(2H2O)中,含有的中子总数为10NA
D.1.0mol·L-1 NaCl溶液中含有NA个Cl-
难度: 中等查看答案及解析
-
下列关于离子反应的说法中正确的是
A.硫酸亚铁加过氧化氢溶液离子方程式为:Fe2+ + H2O2 + 2H+
Fe3+ + 2H2O
B.碘水中通入足量的SO2离子方程式为:I2 +SO2+2H2O=2I-+SO42-+4H+
C.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-可大量共存
D.使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ均正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
Fe2O3是红棕色粉末
Fe2O3常用作红色涂料
B
SiO2是两性氧化物
SiO2可和HF反应
C
Al2O3难溶于水
Al2O3可用作耐火材料
D
SO2有氧化性
SO2可使溴水褪色
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O===2Fe2++SO
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4
难度: 中等查看答案及解析
-
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是

难度: 中等查看答案及解析
-
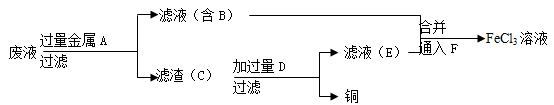
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
A.NO2 B.NO C.N2O D.NH4NO3
难度: 中等查看答案及解析
-
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.明矾溶液中滴加Ba(OH)2溶液至SO
完全沉淀:Al3++Ba2++SO
+3OH-===BaSO4↓+Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D.MgSO4溶液与Ba(OH)2溶液混合:SO42-+Ba2+=BaSO4↓
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA
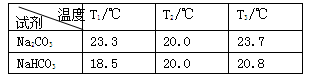
B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
C.12 g石墨和C60的混合物中质子总数为6NA个
D.常温常压下,22.4L乙烯中C−H键数为4NA
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是
A.洗气瓶中产生的沉淀是碳酸钡 B.在Z导管出来的气体中有二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡 D.在Z导管口有红棕色气体出现
难度: 中等查看答案及解析